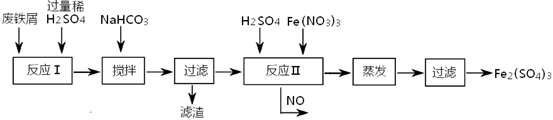
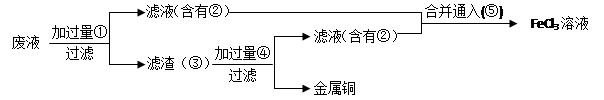
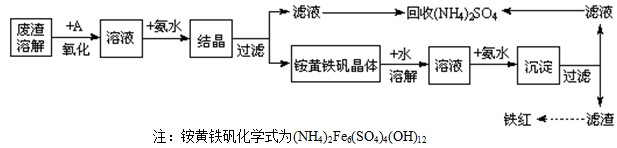
题目内容
将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+溶度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
| A.2 :3 | B.3 :2 | C.1 :2 | D.1 :1 |
A
试题分析:已反应的Fe3+和未反应的Fe3+的物质的量分别是x和y,则根据方程式可知
2Fe3++Fe=3Fe2+
2mol 1mol 3mol
x 1.5x
所以y=1.5x
解得x︰y=2 :3
答案选A
点评:该题是基础性试题的考查,难度不大,主要是考查学生灵活运用基础知识解决问题的能力。该题是常规性计算题的考查,直接根据方程式列式计算即可。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
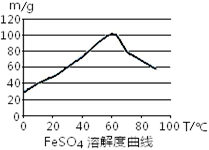
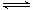 4Fe3++2H2O
4Fe3++2H2O