题目内容
【题目】MnO2是一种重要的无机材料,某设计小组将粗MnO2样品(含有较多的MnO和MnCO3)转化为纯MnO2进行实验,其流程如图所示,下列说法正确的是( )
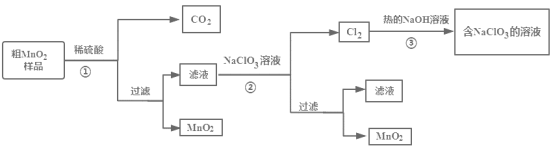
A.步骤①中加稀H2SO4,粗MnO2样品中的MnO2、MnO和MnCO3均转化为可溶物质
B.步骤②反应离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
C.步骤③反应后得到的溶液中溶质主要是NaClO3、NaOH
D.该流程中可以循环利用的物质只有NaClO3
【答案】B
【解析】
粗MnO2(含有较多的MnO和MnCO3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液Ⅰ为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液Ⅱ和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
A. 第①步加入H2SO4时,MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4 ,故A错误;
B. 由电子、电荷守恒可知,发生的离子反应为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+ ,故B正确;
C. 氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,故③反应后得到的溶液中溶质主要是NaClO3、NaOH、NaCl,故C错误;
D. 由工艺流程图可以看出,循环利用的是H2SO4和NaClO3,故D错误;
正确答案是B。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大