��Ŀ����
����Ŀ��ú���ۺ����ö��ڸ��ƴ�����������Դ�����������Ҫ�����壮
��1������˵����ȷ����������ţ���
a��ú�����л��������������ɵĸ��ӻ����
b��ú��ȼ�չ����л�����һ����̼����������������̳����к�����
c����������ʯ�ҡ���ʯ�ҡ�ʯ��ʯ�ȹ����ʹú��ȼ�չ����������ȶ���������
d��ú�ĸ������ڻ�ѧ�仯��ú��������Һ�������������仯
��2��ú�����������в������к�����H2S�ð�ˮ�����������ε����ӷ���ʽ�� ��
��3��ȼú������һ�����������һʯ��һʯ�෨����ͼ1���£� 
�ٳ����£���NaOH��Һ����SO2�õ�pH=6��NaHSO3��Һ������Һ������Ũ�ȵĴ�С˳����
������������NaHSO3��Ӧ�Ļ�ѧ����ʽ��
��4��ú�ļ��Һ�����ϳɶ����ѵ�������Ӧ���£���.2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1
��.2CH3OH��g��CH3OCH3��g��+H2O��g����H=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��41.3kJmol��1
���ܷ�Ӧ�Ȼ�ѧ����ʽ��3H2��g��+3CO��g��CH3OCH3��g��+CO2��g����H=��
��Y��Y1��Y2����X�ɷֱ����ѹǿ���¶ȣ���ͼ2��ʾYһ��ʱ���ܷ�Ӧ��CO��ƽ��ת������X�ı仯��ϵ���ж�Y1��Y2�Ĵ�С��ϵ�����������ɣ� ��
���𰸡�
��1��abc
��2��H2S+2NH3?H2O�T2 ![]() +S2��+2H2O
+S2��+2H2O
��3��c��Na+����c��HSO3������c��H+����c��SO32������c��OH������Ca��OH��2+NaHSO3�TCaSO3��+NaOH+H2O
��4����246.4 kJ?mol��1��Y1��Y2 �� ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����֪��ѹǿ����CO��ƽ��ת���������¶����ߣ�CO��ƽ��ת���ʼ�С������X����ѹǿ��Y�����¶ȣ�ѹǿһ��ʱ���¶�Խ��ƽ��ת����Խ��
����������1��a��ú�����л��������������ɵĸ��ӵĻ�����Ҫ����CԪ�أ���a��ȷ��b��ú�а�����Ԫ�غ͵�Ԫ�أ�����ȫȼ��ʱ����һ����̼����������������̳����к����ʣ���b��ȷ��c��̼������ȷֽ�Ϊ�����ƣ�������������������������������ơ������Ʒ�����Ӧ����������ƣ�Ȼ���������������ȶ��������Σ���c��ȷ��d��ú�ĸ���ú��������Һ�������ڻ�ѧ�仯����d�������Դ��ǣ�abc����2��H2S�ð�ˮ��������������狀�ˮ�����ӷ���ʽΪH2S+2NH3H2O�T2 ![]() +S2��+2H2O�����Դ��ǣ�H2S+2NH3H2O�T2
+S2��+2H2O�����Դ��ǣ�H2S+2NH3H2O�T2 ![]() +S2��+2H2O����3���ٳ����£�NaHSO3��Һ��pH=6��NaHSO3��Һ�����ԣ�NaHSO3��Һ�д��������������ˮ������룬ˮ�����ʼ��ԣ����뵼��������ԣ��ݴ˷���������̶ȴ���ˮ��̶ȣ�������Ũ�ȴ�СΪ��c��Na+����c��HSO3������c��H+����c��SO32������c��OH���������Դ��ǣ�c��Na+����c��HSO3������c��H+����c��SO32������c��OH������������������NaHSO3��Ӧ���ɳ���������ơ�NaOH��ˮ����ѧ����ʽΪCa��OH��2+NaHSO3�TCaSO3��+NaOH+H2O�����Դ��ǣ�Ca��OH��2+NaHSO3�TCaSO3��+NaOH+H2O����4���٣���2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1��2CH3OH��g��CH3OCH3��g��+H2O��g����H=��23.5kJmol��1��CO��g��+H2O��g��CO2��g��+H2��g����H=��41.3kJmol��1�ɸ�˹���ɢ�+��+�١�2�õ�3H2��g��+3CO��g��CH3OCH3��g��+CO2��g���ġ�H=��246.4 kJmol��1 �� ���Դ��ǣ���246.4 kJmol��1����3H2��g��+3CO��g��CH3OCH3��g��+CO2��g����H��0������Ӧ���������С�������¶ȣ�ƽ�������ƶ���CO��ƽ��ת���ʼ�С������ѹǿ��ƽ�������ƶ���CO��ƽ��ת�����������X����ѹǿ��Y�����¶ȣ���ѹǿ�����£��¶�Խ�ߣ�CO��ƽ��ת����ԽС�����Y1��Y2 �� ���Դ��ǣ�Y1��Y2 �� ��3H2��g��+3CO��g��CH3OCH3��g��+CO2��g����֪��ѹǿ����CO��ƽ��ת���������¶����ߣ�CO��ƽ��ת���ʼ�С������X����ѹǿ��Y�����¶ȣ�ѹǿһ��ʱ���¶�Խ��ƽ��ת����Խ��
+S2��+2H2O����3���ٳ����£�NaHSO3��Һ��pH=6��NaHSO3��Һ�����ԣ�NaHSO3��Һ�д��������������ˮ������룬ˮ�����ʼ��ԣ����뵼��������ԣ��ݴ˷���������̶ȴ���ˮ��̶ȣ�������Ũ�ȴ�СΪ��c��Na+����c��HSO3������c��H+����c��SO32������c��OH���������Դ��ǣ�c��Na+����c��HSO3������c��H+����c��SO32������c��OH������������������NaHSO3��Ӧ���ɳ���������ơ�NaOH��ˮ����ѧ����ʽΪCa��OH��2+NaHSO3�TCaSO3��+NaOH+H2O�����Դ��ǣ�Ca��OH��2+NaHSO3�TCaSO3��+NaOH+H2O����4���٣���2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1��2CH3OH��g��CH3OCH3��g��+H2O��g����H=��23.5kJmol��1��CO��g��+H2O��g��CO2��g��+H2��g����H=��41.3kJmol��1�ɸ�˹���ɢ�+��+�١�2�õ�3H2��g��+3CO��g��CH3OCH3��g��+CO2��g���ġ�H=��246.4 kJmol��1 �� ���Դ��ǣ���246.4 kJmol��1����3H2��g��+3CO��g��CH3OCH3��g��+CO2��g����H��0������Ӧ���������С�������¶ȣ�ƽ�������ƶ���CO��ƽ��ת���ʼ�С������ѹǿ��ƽ�������ƶ���CO��ƽ��ת�����������X����ѹǿ��Y�����¶ȣ���ѹǿ�����£��¶�Խ�ߣ�CO��ƽ��ת����ԽС�����Y1��Y2 �� ���Դ��ǣ�Y1��Y2 �� ��3H2��g��+3CO��g��CH3OCH3��g��+CO2��g����֪��ѹǿ����CO��ƽ��ת���������¶����ߣ�CO��ƽ��ת���ʼ�С������X����ѹǿ��Y�����¶ȣ�ѹǿһ��ʱ���¶�Խ��ƽ��ת����Խ��
�����㾫����������Ҫ�����˻�ѧƽ���ƶ�ԭ���Լ�Ӱ�����ص����֪ʶ�㣬��Ҫ����Ӱ�����أ���Ũ�ȣ�����Ӧ����С�����Ũ�ȣ�ƽ��������Ӧ�����ƶ�����ѹǿ������ѹǿƽ�������������С�ķ����ƶ�����Сѹǿƽ���������������ķ����ƶ������¶ȣ������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ��������¶ȣ�ƽ������ȷ�Ӧ�����ƶ����ܴ���������Ӱ��ƽ���ƶ�������ȷ�����⣮

 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�����Ŀ��ú��һ����Ҫ�Ļ���ԭ�ϣ����ǽ�����ú��ȡ��ˮú������̿�����ѵȹ㷺���ڹ�ũҵ�����У�
��1����֪�� 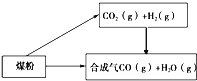
��C��s��+H2O��g���TCO��g��+H2��g����H=+131.3kJmol��1
��CO2��g��+H2��g���TCO��g��+H2O��g����H=+41.3kJmol��1
��̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ �� �÷�Ӧ��������¡��������¡����κ��¶ȡ����������������Է����У�
��2����������̿��ԭ�������������������ӦC��s��+2NO��g��N2��g��+CO2��g������ij�ܱ������м���һ�����Ļ���̿��NO����T1��ʱ����ͬʱ���ø����ʵ�Ũ�����±���ʾ��
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��10��20min�ڣ�N2��ƽ����Ӧ����v��N2��=��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������������ĸ��ţ�
A��ͨ��һ������NO
B������һ�����Ļ���̿
C��������ʵĴ���
D���ʵ���С���������
��3���о���������ӦCO��g��+H2O��g��H2��g��+CO2��g��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����Ӧ��500��ʱ���У�����ʼʱCO��H2O��Ũ�Ⱦ�Ϊ0.020molL��1 �� �ڸ������´ﵽƽ��ʱ��CO��ת����Ϊ��
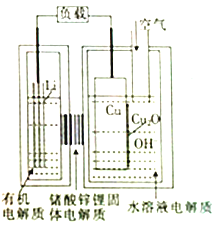
��4����CO��ȼ�ϵ�ص��CuSO4��Һ��FeCl3��FeCl2���Һ��ʾ��ͼ��ͼ1��ʾ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��
������A�������������ڱ�״���µ����Ϊ��
�ڱ�װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ��ͼ2��ʾ����ͼ�Т��߱�ʾ�����������ӷ��ţ��ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������ҪmL5.0molL��1 NaOH��Һ��