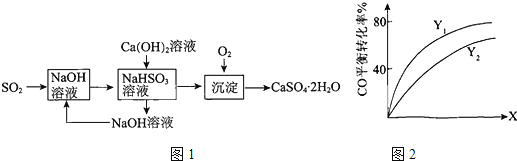
题目内容
【题目】盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题: ①已知:H2O(g)═H2O(l)△H1=﹣Q1 kJmol﹣1
C2H5OH(g)═C2H5OH(l)△H2=﹣Q2kJmol﹣1
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=﹣Q3kJmol﹣1
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 kJ.
②C(s)在氧气供应不充足时会生成CO,但还是无法通过实验直接测得反应:C(s)+ ![]() O2(g)═CO(g)的△H,其原因是 .
O2(g)═CO(g)的△H,其原因是 .
【答案】3Q1﹣Q2+Q3;会有部分二氧化碳生成(或C不能完全转化为CO或其它合理答案)
【解析】解:①已知:a.H2O(g)═H2O(l)△H1=﹣Q1 kJ/mol,
b.C2H5OH(g)═C2H5OH(l)△H2=﹣Q2 kJ/mol,
c.C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=﹣Q3 kJ/mol,
依据盖斯定律计算3a+c﹣b得到液态无水酒精完全燃烧,生成气态CO2和液态H2O的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=﹣( 3Q1﹣Q2+Q3) kJ/mol,46g液态无水酒精物质的量= ![]() =1mol,则完全燃烧,并恢复到室温,则整个过程中放出的热量为3Q1﹣Q2+Q3,
=1mol,则完全燃烧,并恢复到室温,则整个过程中放出的热量为3Q1﹣Q2+Q3,
所以答案是:3Q1﹣Q2+Q3;
②碳易与氧气反应部分生成二氧化碳,难以与氧气反应全部生成一氧化碳,导致无法测定反应热,
所以答案是:会有部分二氧化碳生成(或C不能完全转化为CO或其它合理答案).
【考点精析】根据题目的已知条件,利用反应热和焓变的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热.