题目内容
20.某校化学兴趣小组为探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因反应放热,一段时间后溶液温度升高,反应速率加快;②由于铁中含杂质铜,反应时形成Fe-Cu微型原电池,加快反应速率.
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol•L-1 KSCN溶液;0.1mol•L-1 KI溶液;0.2mol•L-1酸性高锰酸钾溶液;氯水等;试管和滴管.
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ | Fe3++3SCN-=Fe(SCN)3 |
| 第二步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+. | 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
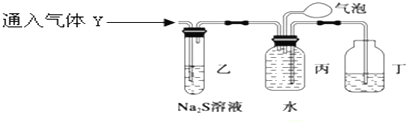
(3)装置乙的作用:验证NO2的存在并除去NO2.
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理
由.不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L-1酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为1:3.(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
分析 (1)根据影响化学反应速率的因素:温度,原电池原理的角度来回答;
(2)可以选择硫氰酸钾来检验三价铁离子,高锰酸根离子具有氧化性,可以将还原性的离子亚铁离子氧化;
(3)根据NO2与Na2S溶液反应的现象知识来回答;
(4)NO2与水反应也能生成NO和硝酸;
(5)可以根据化学方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O进行相应的计算.
解答 解:(1)①将粗铁粒投入某浓度硝酸中,发现反应进行一段时间后,反应开始逐渐加快,可从2个方面答:其一是温度原因,其二是形成原电池,
故答案为:反应放热,一段时间后溶液温度升高,反应速率加快; ②由于铁中含杂质铜,反应时形成Fe-Cu 微型原电池,加快反应速率;
(2)可以选择硫氰酸钾来检验三价铁离子,存在三价铁离子时,溶液变红色,亚铁离子具有还原性,可以被高锰酸钾氧化为三价铁离子,导致高锰酸钾褪色,故答案为:
| 步骤 | 操作 | 现象与结论 | 可能的离子方程式 |
| 第1步 | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ | Fe3++3SCN-=Fe(SCN)3 | |
| 第2步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 | 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
故答案为:验证NO2的存在并除去NO2;
(4)由于NO2与水反应也能生成NO,故不能确定气体Y中含NO,可以在乙和丙装置间加一个检验NO2是否除尽装置,
故答案为:不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO;
(5)由5NO2-~2 MnO4-,故2n(NO2-)=7.5×10-3 mol,设NO、NO2的物质的量分别为x、y mol,则有:x+y=10×10-3 mol,2x+$\frac{1}{2}$(y-x)=7.5×10-3,
解得:x=2.5×10-3 mol,y=7.5×10-3 mol,气体Y中NO、NO2的体积比为1:3,
故答案为:1:3.
点评 本题是一道实验探究题目,考查学生分析和解决问题的能力,考查角度广,注意物质性质和反应现象的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列表示物质结构的化学用语或模型图正确的是( )
| A. | H2O2的电子式: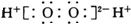 | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |
8.下列说法正确的是( )
| A. | 原子最外层电子数大于3的元素一定是非金属元素 | |
| B. | 碱金属单质的密度随原子序数的增大而依次增大 | |
| C. | 一个氕原子实际上就是一个质子 | |
| D. | 某元素形成的离子为${\;}_{a}^{b}$Xn-,则1个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$g |
15.容量瓶上标有的是:①温度、②浓度、③容量、④质量、⑤刻度线、⑥密度,其中正确的是( )
| A. | ①③⑤ | B. | ③⑤⑥ | C. | ①⑤⑥ | D. | ②③⑤ |
5.下列溶液中,物质的量浓度最大的是( )
| A. | 1LH2SO4溶液中含98gH2SO4 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1L含196gH2SO4的溶液 |
12.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O$\frac{\underline{\;充电\;}}{放电}$Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时在阴极上发生反应的是( )
| A. | Ni(OH)2 | B. | Cd(OH)2 | C. | Cd | D. | NiOOH |
9.在标准状况下进行下列实验:甲、乙、丙各取30.00ml同浓度的盐酸,加入同一镁铝合金,产生气体,测得有关数据列表如表:
(1)分析表格数据后填空:
①盐酸的物质的量浓度为1 mol•L-1.
②据甲(填实验序号)中的数据,可计算出合金中镁与铝的物质的量分别为0.005mol;0.005mol.
(2)在丙实验之后,向容器中加入一定量1.00mol•L-1的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体.请计算:
①滤液中的溶质及其物质的量是NaCl为0.03mol,NaAlO2为0.009mol.
②加入NaOH溶液的体积为39mL.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
①盐酸的物质的量浓度为1 mol•L-1.
②据甲(填实验序号)中的数据,可计算出合金中镁与铝的物质的量分别为0.005mol;0.005mol.
(2)在丙实验之后,向容器中加入一定量1.00mol•L-1的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体.请计算:
①滤液中的溶质及其物质的量是NaCl为0.03mol,NaAlO2为0.009mol.
②加入NaOH溶液的体积为39mL.
10.如图与对应的叙述一定正确的是( )


| A. | ①所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | ②表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂 | |
| C. | ③所示,t1℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2℃时,两种溶液中溶质的质量分数不再相等 | |
| D. | ④所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |