题目内容
10.下列表示物质结构的化学用语或模型图正确的是( )| A. | H2O2的电子式: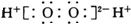 | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |
分析 A.过氧化氢属于共价化合物,分子中氧原子之间形成1对共用电子对,氢原子与氧原子之间形成1对共用电子对;
B.结构式中需要用短线代替所有的共用电子对;
C.硫原子的核电荷数为=核外电子总数=16,最外层为6个电子;
D.乙醇是含有2个碳原子的饱和一元醇,据此写出其分子式.
解答 解:A.过氧化氢属于共价化合物,分子中氧原子之间形成1对共用电子对,氢原子与氧原子之间形成1对共用电子对,其正确的电子式为 ,故A错误;
,故A错误;
B.CH2=CH2为乙烯的结构简式,乙烯的结构式为: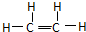 ,故B错误;
,故B错误;
C.硫原子核外存在16个电子,核内有16个质子,其原子结构示意图为: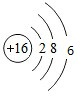 ,故C错误;
,故C错误;
D.乙醇分子中含有2个C、6个H、1个O原子,其分子式为:C2H6O,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及结构式、电子式、原子结构示意图、分子式等知识,明确常见化学用语的书写原则为简单的关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
20.已知2A2(g)+B2(g)?2C3(g)△H=-a kJ/mol(a>0),在一个有催化剂、固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达到平衡后C3的浓度为x mol•L-1,放出热量b KJ.请回答下列问题.
(1)a>(填“>”、“=”或“<”)b.
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<(填“>”、“<”或“=”)T2.
若在原来的容器中,只加入2mol C3,500℃时充分反应达到平衡后,吸收热量c KJ,则C3的浓度=(填“>”、“=”或“<”)x mol•L-1,a、b、c之间满足何种关系?a=b+c(用代数式表示).
(3)在相同条件下要得到2a KJ热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2和2mol C3
C.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量d kJ,则d>(填“>”、“=”或“<”)b,理由是由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多.
(6)在一定温度下,向一个容积不变的容器中通入2mol A2和1mol B2及适量固体催化剂,使反应达到平衡.保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,则平衡时A2的转化率变大(填“不变”、“变大”“变小”或“不能确定”).
(1)a>(填“>”、“=”或“<”)b.
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<(填“>”、“<”或“=”)T2.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)在相同条件下要得到2a KJ热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2和2mol C3
C.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量d kJ,则d>(填“>”、“=”或“<”)b,理由是由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多.
(6)在一定温度下,向一个容积不变的容器中通入2mol A2和1mol B2及适量固体催化剂,使反应达到平衡.保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,则平衡时A2的转化率变大(填“不变”、“变大”“变小”或“不能确定”).
18. 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | W的氢化物比X的氢化物的稳定性高 | |
| C. | Y元素比W元素的非金属性强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
5.下列关于高分子化合物的叙述正确的是( )
| A. | 高分子化合物结构复杂,相对分子质量很大 | |
| B. | 对于一块高分子材料来说,n是一个整数,因而它的相对分子质量是确定的 | |
| C. | 高分子化合物是纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料 |
15.下列说法正确的是( )
| A. | CaCl2、NaOH、HCl、HD四种物质均属于化合物 | |
| B. | 明矾和漂白粉常分别用于自来水的净化和杀菌消毒,两者作用原理不同 | |
| C. | 工业上都采用电解氯化物的方法来制取钠、镁和铝 | |
| D. | SiO2既能与HF反应又能和NaOH反应,所以SiO2属于两性氧化物 |
2.燃料电池是一类应用广泛的原电池.乙醇碱性燃料电池便是一种典型的代表.该电池负极
的电极反应为( )
的电极反应为( )
| A. | C2H5OH-12e-+12OH-═2CO2+9H2O | B. | O2+4H++4e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | C2H5OH+16OH--12e-═2CO32-+11H2O |
19.下列叙述错误的是( )
| A. | Si可用于制造太阳能电池 | |
| B. | Na2O2可用于呼吸面具中作为氧气的来源 | |
| C. | Fe2O3常用于制造红色油漆和涂料 | |
| D. | 常温下可用铝制容器盛装稀硫酸 |
20.某校化学兴趣小组为探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因反应放热,一段时间后溶液温度升高,反应速率加快;②由于铁中含杂质铜,反应时形成Fe-Cu微型原电池,加快反应速率.
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol•L-1 KSCN溶液;0.1mol•L-1 KI溶液;0.2mol•L-1酸性高锰酸钾溶液;氯水等;试管和滴管.
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
探究二
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
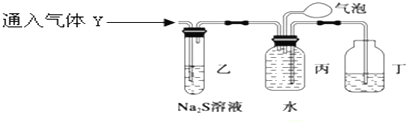
(3)装置乙的作用:验证NO2的存在并除去NO2.
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理
由.不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L-1酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为1:3.(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因反应放热,一段时间后溶液温度升高,反应速率加快;②由于铁中含杂质铜,反应时形成Fe-Cu微型原电池,加快反应速率.
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol•L-1 KSCN溶液;0.1mol•L-1 KI溶液;0.2mol•L-1酸性高锰酸钾溶液;氯水等;试管和滴管.
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ | Fe3++3SCN-=Fe(SCN)3 |
| 第二步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+. | 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)

(3)装置乙的作用:验证NO2的存在并除去NO2.
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理
由.不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L-1酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为1:3.(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
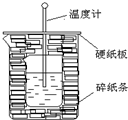 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: