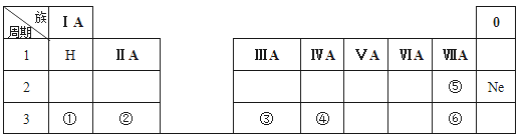
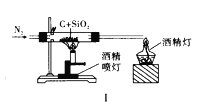
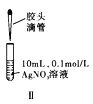
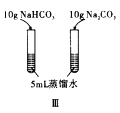
题目内容
【题目】七铝十二钙(12CaO7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
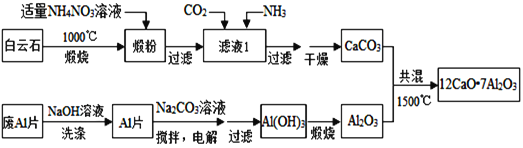
(1)锻粉主要含______和______,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶。该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_______________________________________________.
(2)滤液Ⅰ中阴离子有______(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成______,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为______________________.
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,则铝片接外电源的____极,电解时阴极发生的反应为:______.
(5)一种可超快充电的新型铝电池,充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________________________.
【答案】MgO CaO CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失; NO3-,OH- Ca(HCO3)2 Al2O3 +2 OH-= 2 AlO2-+ H2O; 正 2H2O + 2e- = 2OH- + H2 ; Al - 3 e- + 7 AlCl4- =4 Al2Cl7-;
【解析】
(1)白云石煅烧发生反应:CaCO3 = CaO + CO2↑,MgCO3 = MgO+CO2↑,用(NH4)2SO4代替NH4NO3,生成CaSO4,微溶于水,造成Ca的损失,从而导致CaCO3产率降低;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3H2O,故过滤后溶液中含Ca(NO3)2和NH3H2O,将CO2和NH3通入滤液I中后发生反应:
Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;
(3)NaOH溶液可以与Al2O3反应偏铝酸钠和水,可用NaOH溶液可除去废Al片表面的氧化膜;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,石墨做阴极,阴极为水中氢离子放电;
(5)放电时负极电极本身Al放电,失电子,根据AlCl4-和Al2Cl7-中铝元素和氯元素的比例来确定做AlCl4-做反应物而生成Al2Cl7-。
(1)白云石煅烧发生反应:CaCO3 = CaO + CO2↑,MgCO3 = MgO + CO2↑,故所得煅粉主要含有CaO和MgO,用(NH4)2SO4代替NH4NO3,生成CaSO4,微溶于水,造成Ca的损失;
故答案为:CaO、MgO; CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3H2O,故过滤后溶液中含Ca(NO3)2和NH3H2O,将CO2和NH3通入滤液I中后发生反应:
Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液Ⅰ中阴离子有NO3-,OH-;若滤液Ⅰ中仅通入CO2,会造成CO2过量,会生成Ca(HCO3)2,从而导致CaCO3产率降低;
故答案为:NO3-,OH-;Ca(HCO3)2;
(3)NaOH溶液可以与Al2O3反应偏铝酸钠和水,可用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为:Al2O3 +2 OH-= 2 AlO2 - + H2O;
故答案为:Al2O3 +2 OH-= 2 AlO2 - + H2O;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,石墨做阴极,则铝片接外电源的正极,阴极为水中氢离子放电,电极反应式为:2H2O + 2e- = 2OH- + H2 ;
故答案为:正;2H2O + 2e- = 2OH- + H2 ;
(5)放电时负极电极本身Al放电,失电子,由于AlCl4-中氯元素的含量高于Al2Cl7-中氯元素的含量,故AlCl4-做反应物,而Al2Cl7-为生成物,由于其它离子不参与电极反应,故电极反应式为:Al - 3 e- + 7 AlCl4- =4 Al2Cl7-;

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】某工厂的氨氮废水中主要含有![]() ,可用电化学氧化法加以处理。
,可用电化学氧化法加以处理。
(1)图1是电化学氧化法的原理示意图。a的电极反应式是_____________。
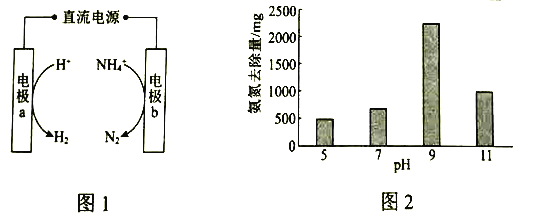
(2)研究显示,其他条件不变时,不同![]() 下氨氮的去除量如图2所示。已知:
下氨氮的去除量如图2所示。已知:![]() 与
与![]() 相比,在电极表面的吸附效果更好。结合平衡移动原理和图中数据,解释
相比,在电极表面的吸附效果更好。结合平衡移动原理和图中数据,解释![]() 从5到9时氨氮去除量增大的原因:______________。
从5到9时氨氮去除量增大的原因:______________。
(3)在电解废水的过程中,![]() 会经历“
会经历“![]() ”的过程。其他条件相同、
”的过程。其他条件相同、![]() 的浓度不同时,废水中氨氮脱除效率的实验结果如下:
的浓度不同时,废水中氨氮脱除效率的实验结果如下:
| 400 | 100 |
电解时间/h | 0.5 | 0.5 |
氨氮脱除效率/( | 2.40.8 |
①其它条件相同、适当提高![]() 的浓度,可以显著增大废水中
的浓度,可以显著增大废水中![]() 的脱除效率。
的脱除效率。
用化学用语解释原因:____________、![]() 。
。
②图2中,![]() 时,废水中
时,废水中![]() 去除量下降,可能的原因是:_______________。
去除量下降,可能的原因是:_______________。