��Ŀ����
����Ŀ��ˮú����CO ��H2������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�C(s) + H2O(g) ![]() CO(g) +H2(g) ��H��+131.3 kJ��mol-1��
CO(g) +H2(g) ��H��+131.3 kJ��mol-1��
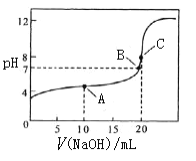
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�___________��ѡ����� ��С�����䡱��
��2��������Ӧ�ﵽƽ�����ϵ�е�C(s)�������ߣ�ƽ��____________��ѡ������ơ��������ơ����ƶ�������
��3��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬����___________������ţ���
A����λ�����ÿ����1 mol CO��ͬʱ����1molH2
B��������������ʵ������ֲ���
C������H2O(g)������������CO���������
D��H2O(g)��CO��H2��Ũ�����
��4��ij�¶��£���4.0 mol H2O(g)��������̿����2 L���ܱ������У��������·�Ӧ��C(s)�� H2O(g) ![]() CO(g)��H2(g)���ﵽƽ��ʱ���K=1������¶���H2O(g)��ת����Ϊ_____��
CO(g)��H2(g)���ﵽƽ��ʱ���K=1������¶���H2O(g)��ת����Ϊ_____��
��5����֪���� C(s)��H2O(l) =CO(g)��H2(g) ��H1
�� 2CO(g)��O2(g)��2CO2 (g) ��H2
�� H2O (l)��H2 (g)��1/2 O2 (g) ��H3
��C(s)��O2 (g)��CO2 (g)�ġ�H��_____________________��
��6���������һ����̼Ϊȼ�ϵļ���ȼ�ϵ�أ�������Ϊͨ��_______���ѧʽ����һ������缫��Ӧʽ�ǣ�__________________________________________________��
���𰸡����� ���ƶ� AB 50% ��H1+��H2/2����H3 O2 O2 + 4e-+ 2H2O=4OH��
��������
��1���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���
��2������ϵ�е�C��s��ȫ�����ߣ��Է�Ӧ���ʺͻ�ѧƽ�ⶼû��Ӱ�죻
��3�����ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��4������������ݽ�������ʽ��ͨ��ƽ�ⳣ�����㣻
��5�����ݸ�˹���ɼ��㣻
��6��ͨ�뻹ԭ��һ����̼��һ��Ϊ������ͨ��������һ��Ϊ������
��1���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�����ѧƽ�ⳣ�����ʴ�Ϊ������
��2��������Ӧ�ﵽƽ�����ϵ�е�C��s��ȫ�����ߣ���Ӱ��ˮ��CO������Ũ�ȱ仯���Է�Ӧ���ʺͻ�ѧƽ�ⶼû��Ӱ�죬ƽ�ⲻ�ƶ����ʴ�Ϊ�����ƶ���
��3��A����λ�����ÿ����1molCO��ͬʱ����1molH2��˵����Ӧ�����淴Ӧ������ȣ�˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬������ȷ��
B����Ӧǰ���������ʵ����仯��������������ʵ������ֲ���˵����Ӧ�ﵽƽ��״̬������ȷ��
C������H2O��g�������ʴ��������ʣ�����CO����������������ʣ����ܱ�����Ӧ�����淴Ӧ������ȣ�����˵����Ӧ�ﵽƽ��״̬���ʴ���
D��H2O��g����CO��H2��Ũ����Ⱥ���ʼ���仯���йأ�������Ϊƽ���־����D����ѡAB���ʴ�Ϊ��AB��
��4����H2O��g����ת����Ϊx�������⽨����������ʽ��
C(s)�� H2O(g) ![]() CO(g)��H2(g)
CO(g)��H2(g)
��mol/L�� 2 0 0
�䣨mol/L�� 2x 2x 2x
ƽ��mol/L�� 2-2x 2x 2x
�ɻ�ѧƽ�ⳣ��K=c(CO)c(H2)/c(H2O)=1,�ɵù�ϵʽ��(2x)2/(2-2x)=1�����ϵʽx=0.5���ʴ�Ϊ��50%��
��5���ɸ�˹���ɷ�Ӧ��+��/2-�ۿɵ�C(s)��O2 (g)��CO2 (g)�����H=��H1+��H2/2����H3,�ʴ�Ϊ����H1+��H2/2����H3��
��6���������һ����̼Ϊȼ�ϵļ���ȼ�ϵ�أ���ͨ�뻹ԭ��һ����̼��һ��Ϊ������ͨ��������һ��Ϊ���������������£������ŵ�ĵ缫��ӦʽΪ���ʴ�Ϊ��O2��O2 + 4e-+ 2H2O=4OH����

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�