题目内容
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
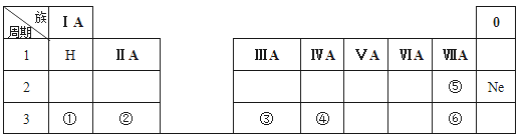
(1)元素④的符号是_______;②的最高价氧化物对应水化物的化学式为_______;⑤和⑥两种元素原子半径的大小关系:⑤_____⑥(填“>”或“<”);
(2)①和②两种元素金属性强弱关系:①_____②(填“>”或“<”);
(3)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为:___________。
【答案】Si Mg(OH)2 < > 2NaOH+2Al+2H2O=2NaAlO2+3H2↑
【解析】
根据元素在周期表中的相对位置首先判断出元素,然后结合元素周期律以及有关物质的性质分析解答。
由元素在周期表中位置可知,①为Na、②为Mg、③为Al、④为Si、⑤为F、⑥为Cl,则
(1)元素④是硅,元素符号是Si;②是Mg,最高价氧化物对应水化物的化学式为Mg(OH)2;同主族随原子序数增大,原子半径逐渐增大,故原子半径F<Cl;
(2)①为Na、②为Mg,二者处于同一周期,原子序数越大,金属性越弱,则金属性大小为:Na>Mg;
(3)①的最高价氧化物的水化物为NaOH,元素③的单质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目