题目内容
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
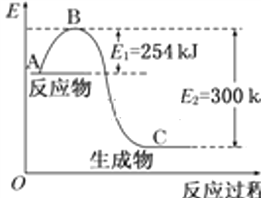
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________________________。
(2)已知化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ/mol。若已知下列(右表)数据,试根据表中及图中数据计算N—H的键能____________kJ/mol。
化学键 | H—H | N≡N |
键能/kJ/mol | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ; ΔH1=-a kJ/mol ①
N2(g)+O2(g)===2NO(g) ; ΔH2=-b kJ/mol ②
若1 mol NH3还原NO至N2,则反应过程中的反应热ΔH3=________ kJ/mol(用含a、b的式子表示)。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) ===2Fe(s)+3CO2(g) ; ΔH1=-25 kJ/mol
②3Fe2O3(s)+CO(g)=== 2Fe3O4(s)+CO2(g) ; ΔH2=-47 kJ/mol
③Fe3O4(s)+CO(g) ===3FeO(s)+CO2(g) ;ΔH3=+640 kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式______________。
【答案】 N2(g)+3H2(g)![]() 2NH3(g); ΔH=-92 kJ/mol( 390
2NH3(g); ΔH=-92 kJ/mol( 390 ![]() FeO(s)+CO(g) ===Fe(s)+CO2(g);ΔH=-218 kJ/mol
FeO(s)+CO(g) ===Fe(s)+CO2(g);ΔH=-218 kJ/mol
【解析】本题主要考查热化学方程式。
(1)N2和H2反应的热化学方程式:N2(g)+3H2(g)![]() 2NH3(g); ΔH=-92 kJ/mol。
2NH3(g); ΔH=-92 kJ/mol。
(2)设N—H的键能为xkJ/moi,ΔH=-92kJ/mol=反应物键能-生成物键能=(3 ×435+943-6x)kJ/mol,x=390,所以N—H的键能为390kJ/mol。
(3)①-3②得4NH3(g)+6NO(g)==5N2(g)+6H2O(g) ; ΔH1-3ΔH2=(3a-b)kJ/mol,若1 mol NH3还原NO至N2,则反应过程中的反应热ΔH3=![]() kJ/mol。
kJ/mol。
(4)①-②/3-③/3得FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式:FeO(s)+CO(g) ===Fe(s)+CO2(g);ΔH=-218 kJ/mol。

 阅读快车系列答案
阅读快车系列答案【题目】下列除杂(括号内为杂质)所选用的试剂及操作方法均正确的一组是( )
待提纯的物质 | 选用的试剂 | 操作方法 | |
A | NaOH (Na2CO3) | 盐酸 | —— |
B | CO2 (HCl) | Na2CO3溶液 | 洗气 |
C | FeCl3 (FeCl2) | 铁粉 | 过滤 |
D | Mg (Al) | NaOH溶液 | 过滤 |
A. A B. B C. C D. D

