题目内容
【题目】如图装置中久置后铁片会被腐蚀,有关此装置的叙述中正确的是( ) 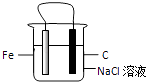
A.铁片为正极,碳棒为负极
B.碳棒附近的溶液可使酚酞变红
C.铁被腐蚀,碳棒上有氯气放出
D.导线上有电流通过,电流方向是由铁极流向碳极
【答案】B
【解析】解:A、铁做负极,碳做正极,故A错误;
B、碳棒上氧气放电:O2+4e﹣+2H2O=4OH﹣ , 有氢氧根生成,故能使酚酞变红,故B正确;
C、铁做负极被腐蚀,在碳棒上放电的是氧气,无氯气生成,故C错误;
D、此原电池中,电子由铁流向碳,则电流由碳流向铁,故D错误.
故选B.
【考点精析】解答此题的关键在于理解金属的电化学腐蚀与防护的相关知识,掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________________________。
(2)已知化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ/mol。若已知下列(右表)数据,试根据表中及图中数据计算N—H的键能____________kJ/mol。
化学键 | H—H | N≡N |
键能/kJ/mol | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ; ΔH1=-a kJ/mol ①
N2(g)+O2(g)===2NO(g) ; ΔH2=-b kJ/mol ②
若1 mol NH3还原NO至N2,则反应过程中的反应热ΔH3=________ kJ/mol(用含a、b的式子表示)。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) ===2Fe(s)+3CO2(g) ; ΔH1=-25 kJ/mol
②3Fe2O3(s)+CO(g)=== 2Fe3O4(s)+CO2(g) ; ΔH2=-47 kJ/mol
③Fe3O4(s)+CO(g) ===3FeO(s)+CO2(g) ;ΔH3=+640 kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式______________。
