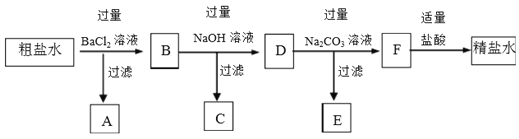
��Ŀ����
����Ŀ���ú�ˮ��ɹ�Ρ��ķ����õ��Ĵ����У����Ȼ����⣬�������Ȼ�þ���Ȼ��ơ������Ƶ����ʡ����˴����ᴿ�IJ���ʵ�鷽�����£�
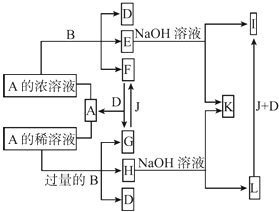
��1������ˮ�к��е���������_______����������__________��
��2������BaCl2��Һ��Ŀ���ǣ������ӷ���ʽ��ʾ��_________��
��3�����ɳ���C�����ӷ���ʽ��______��
��4��D������������_______��
��5��E����Ҫ�ɷֵĻ�ѧʽ��____��
��6�������������������������Ŀ����________��
��7��ijͬѧ��Ϊ�������K2CO3��Һ��������Na2CO3��Һͬ�����Դﵽʵ��Ŀ�ģ�����˵���Ƿ��������˵������______________��
���𰸡� Mg2+��Ca2+��Na+ Cl- SO42- Ba2++ SO42- =BaSO4�� Mg2++2OH-=Mg(OH)2�� Ba2+��Ca2+��Na+��Cl-��OH- CaCO3��BaCO3 ��ȥOH-��CO32- ����������Ȼ����̼���Ҳ���Գ�ȥ��Һ�е�Ca2+������ͬʱҲ������K+�����µ��������ӣ�����K+���׳�ȥ��
����������1�������У����Ȼ����⣬�������Ȼ�þ���Ȼ��ơ������Ƶ����������Դ���ˮ�к��е���������Mg2+��Ca2+��Na+����������Cl-��SO42-����2������BaCl2��Һ��Ŀ���dz�ȥ��������ӣ���Ӧ�����ӷ���ʽΪBa2++ SO42- =BaSO4������3���������Ƴ���þ���ӣ������ɳ���C������þ�����ӷ���ʽ��Mg2++2OH-=Mg(OH)2������4�������Ȼ������������ƾ��ǹ����ģ���D������������Ba2+��Ca2+��Na+��Cl-��OH-����5��̼���Ƴ�ȥ�������Լ������ı����ӣ���E����Ҫ�ɷֵĻ�ѧʽ��CaCO3��BaCO3����6�������������ƺ�̼���ƹ�������������������Ŀ���dz�ȥOH-��CO32-����7����Ȼ����̼���Ҳ���Գ�ȥ��Һ�е�Ca2+������ͬʱҲ������K+�����µ��������ӣ�����K+���׳�ȥ�������Dz���������

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ��CH3COCH3+Br2 ![]() CH3COCH2Br+HBr�����о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ����v��Br2��ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br+HBr�����о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ����v��Br2��ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/molL��1 | ����ɫ��ʧ�����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ��۲���ȷ���ǣ� ��
A.����c��CH3COCH3����v��Br2������
B.ʵ��ں͢۵�v��Br2�����
C.����c��HCl����v��Br2������
D.����c��Br2����v��Br2������