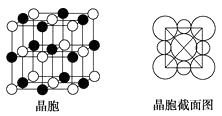
题目内容
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
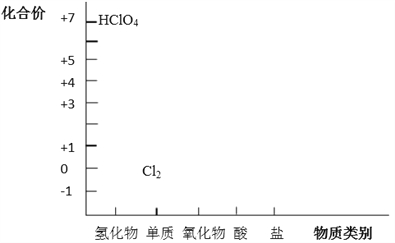
(1)根据图中信息,写出任意两种氯的氧化物的化学式_____________。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式__________。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式__________。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式___________。
(4)Cl2既具有氧化性,又具有还原性,请结合上图说明原因_________。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式_________。
【答案】 Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等中任意两种 HClO4+NaOH=NaClO4+H2O Zn+2H+=Zn2++H2↑ Fe+2H+=Fe2++H2↑ MnO2+4HCl(浓![]() MnCl2+Cl2↑+2H2O Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价可以降低,氯气体现氧化性。 2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O
MnCl2+Cl2↑+2H2O Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价可以降低,氯气体现氧化性。 2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O
【解析】(1)根据图中信息可知氯元素的常见正化合价有+1、+3、+4、+5、+7等,因此氯的氧化物的化学式有Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等。(2)高氯酸(HClO4)是一元强酸,与NaOH反应的化学方程式为HClO4+NaOH=NaClO4+H2O。(3)①金属与盐酸反应生成氢气体现氯化氢的还原性,例如Zn+2H+=Zn2++H2↑、Fe+2H+=Fe2++H2↑等。②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,该反应的化学方程式为MnO2+4HCl(浓![]() MnCl2+Cl2↑+2H2O。(4)Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价可以降低,氯气体现氧化性,即Cl2既具有氧化性,又具有还原性;潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性(还原产物是氯化钠),也体现了还原性(氧化产物是Cl2O),因此根据原子守恒以及电子得失守恒可知反应的化学方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O。
MnCl2+Cl2↑+2H2O。(4)Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价可以降低,氯气体现氧化性,即Cl2既具有氧化性,又具有还原性;潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性(还原产物是氯化钠),也体现了还原性(氧化产物是Cl2O),因此根据原子守恒以及电子得失守恒可知反应的化学方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2 ![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/molL﹣1 | 溴颜色消失所需的时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大