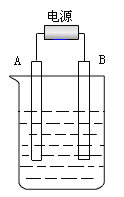
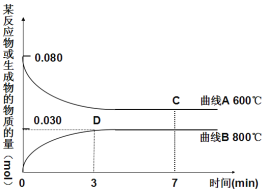
题目内容
【题目】室温下,向20mL浓度均为0.1mol/L的NaOH和MOH溶液中分别滴加0. 1mol/L盐酸,溶液的pH随盐酸体积变化如图所示。下列说法不正确的是( )
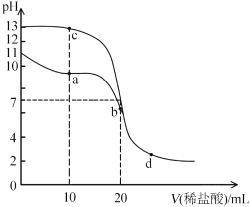
A.MOH的电离常数约为1×l0-5B.a点溶液中存在![]()
C.b点和c点溶液混合后显碱性D.水的电离程度:d>b>a
【答案】D
【解析】
A.据图知,0.1molL1MOH溶液中pH=11,则c(OH)=0.001molL1,MOH电离程度较小,则c(M+)≈c(OH)=0.001molL1,c(MOH)≈0.1molL1,常温下,MOH的电离常数![]() ,A正确;
,A正确;
B.a点溶液呈碱性,则c(H+)<c(OH),根据电荷守恒得c(M+)+c(H+)=c(OH)+c(Cl),所以得c(M+)>c(Cl)≈![]() ,B正确;
,B正确;
C.当盐酸的体积为10mL时,c点溶液为等物质的量浓度![]() 的NaCl和NaOH溶液,当盐酸的体积为20mL时,b点为0.05molL1的MCl溶液,是强酸弱碱盐,水解过程微弱,所以b点和c点溶液混合后显碱性,C正确;
的NaCl和NaOH溶液,当盐酸的体积为20mL时,b点为0.05molL1的MCl溶液,是强酸弱碱盐,水解过程微弱,所以b点和c点溶液混合后显碱性,C正确;
D. a点有碱溶液、d点酸过量,水的电离均受到抑制,b点溶质是强酸弱碱盐,水解时促进水电离,从a到b点水的电离程度增大,从b到d点水的电离程度减小,故D错误;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是________。
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是________(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是________。
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是________。
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中![]() 的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
(2)依据表中数据计算CH3COOH的电离常数Ka=________(已知100.4=2.5,用科学计数法表示)