��Ŀ����
����Ŀ���������dz��õķ���������Ҫ��ҽҩԭ�ϡ�һ��ҩ�ñ�������Ʊ��������£�
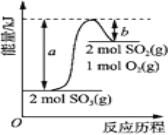
���ڷ�Ӧ���м���ױ�������KMnO4��Һ��Fe2O3�������������ȡ�������Сʱ����ַ�Ӧ��
��Ӧ������Ϊ����װ�á���������ֱ�������ܱڲ��ٳ������顣
����Ӧ���еĻ������ȹ��ˣ�������������ˮϴ�ӡ�
��������Һ�еμ�Ũ�����ữ��pH=2�����ˣ�������ˮϴ�ӣ�����ñ������Ʒ��
�������ֱ�������롭�����ᾧ��ϴ�ӡ����ˣ��õ�ҩ�ô������ᡣ
��֪��������ʵ��ܽ����g/mL��
�¶ȣ����� | 25 | 50 | 60 | |
������ | ��ˮ�� | 0.0034 | 0.0085 | 0.0095 |
���Ҵ��� | 0.4 | 0.7 | 1 | |
�Ȼ��� | ���Ҵ��� | ���� | ||
��1�����з�������Ҫ��ӦΪ��![]() ��δ��ƽ��������з�����Ӧ�����ӷ���ʽΪ______��
��δ��ƽ��������з�����Ӧ�����ӷ���ʽΪ______��
��2�����������Ŀ����______��
��3�����г��ȹ��˵�Ŀ����______��
��4�������������������______��
���𰸡� 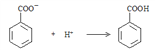 ��OH�� + H+ === H2O ��ȥ�д�ļױ� ���ٱ�����ؽᾧ������������ʧ һ��������Ҵ��У����60��ı�����Һ�����ˣ���Һ����������һ������ˮ��
��OH�� + H+ === H2O ��ȥ�д�ļױ� ���ٱ�����ؽᾧ������������ʧ һ��������Ҵ��У����60��ı�����Һ�����ˣ���Һ����������һ������ˮ��
����������1�����з�������Ҫ��ӦΪ��![]() ��δ��ƽ�������������Һ�еμ�Ũ�����ữ��pH=2��������Ӧ�����ӷ���ʽΪ
��δ��ƽ�������������Һ�еμ�Ũ�����ữ��pH=2��������Ӧ�����ӷ���ʽΪ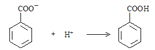 ��OH�� + H+ === H2O��
��OH�� + H+ === H2O��
��2����Ӧ������У����ķе�ϵͣ����Ԣ��������Ŀ���dz�ȥ�д�ļױ���
��3����Ϊ�¶�Խ�ͣ���������ܽ��ԽС�����Ԣ��г��ȹ��˵�Ŀ���Ǽ��ٱ�����ؽᾧ������������ʧ��
��4�����в�����Ϊ���ᴿ�����ᣬ��ȥ���е��Ȼ������ʣ�����������Ϣ��֪��������������Ҵ������Ȼ������ܣ����Կ��Ը���������ʾ����������ᴿ���������ֱ��������һ��������Ҵ��У����60��ı�����Һ�����ˣ���Һ����������һ������ˮ�У��ᾧ��ϴ�ӡ����ˣ��õ�ҩ�ô������ᡣ

����Ŀ���������ƣ�Na2FeO4���Ǿ�����ɫ����ķ�ĩ����һ�ָ�Ч��ɫǿ�������������������ȶ��������ڷ�ˮ��������ˮ�Ĵ�����ʵ������ʯī������Ϊ�缫���Բ�ͬŨ�ȵ�NaOH��ҺΪ�������Һ������һ����ѹ����Ʊ��������ƣ����װ�ú�����������
c(NaOH) | �������� | �������� |
1 mol��L��1 | ������ɫ���� | ������ɫ���壬10min����Һ��ɫ�����Ա仯 |
10 mol��L��1 | ����������ɫ���� | ����������ɫ���壬3min����Һ��Ϊdz�Ϻ�ɫ��������� |
15 mol��L��1 | ����������ɫ���� | ����������ɫ���壬1min����Һ��Ϊdz�Ϻ�ɫ��������� |
����˵������ȷ����

A. aΪ������bΪʯī
B. ������Ҫ������Ӧ��2H2O + 2e��=== H2��+ 2OH��
C. ��Ũ�ȵ�NaOH��Һ�������ڷ���Fe��6e��+ 8OH��=== FeO42��+ 4H2O
D. �Ʊ�Na2FeO4ʱ�����ñ���NaCl��Һ������Ч����������������