ĢāÄæÄŚČŻ
”¾ĢāÄæ”æŹµŃ銔×éÄ£Äā¹¤ŅµÉĻŗ£Ė®Ģįä壬Éč¼ĘČēĻĀŹµŃ锣 »Ų“šĻĀĮŠĪŹĢā£ŗ
¢ń£® ĄūÓĆČēĶ¼ĖłŹ¾×°ÖĆø»¼Æäå£ŗ
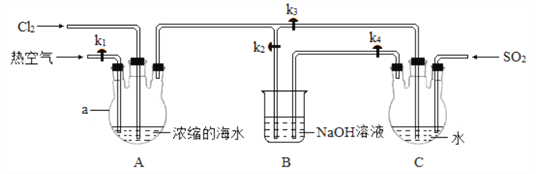
ŹµŃé²½Öč£ŗ
¢Ł¹Ų±Õ k1”¢k3£¬“ņæŖk2£¬Ļņ×°ÖĆA ÖŠĶØČė×ćĮæCl2£¬³ä·Ö·“Ó¦£»
¢ŚĶ£Ö¹ĶØCl2£¬¹Ų±Õk2£¬“ņæŖ k1”¢k3 ŗĶk4£¬ Ļņ×°ÖĆA ÖŠĶØČė×ćĮæČČæÕĘų£¬Ķ¬Ź±Ļņ×°ÖĆCÖŠĶØČė×ćĮæSO2£¬³ä·Ö·“Ó¦£»
¢ŪĶ£Ö¹ĶØĘųĢ壬¹Ų±Õk1”¢k4”£
£Ø1£©a µÄĆū³ĘĪŖ___________”£
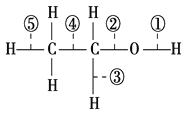
£Ø2£© ²½Öč¢ŁÖŠÖ÷ŅŖ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________”£
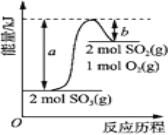
£Ø3£© ²½Öč¢ŚÖŠĶØČėČČæÕĘųµÄ×÷ÓĆĪŖ_______”£ ×°ÖĆ C ·¢Éśø»¼ÆäåµÄ·“Ó¦ÖŠ£¬Ńõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ____________£»Źµ¼Ź²Ī¼Ó·“Ó¦µÄSO2 µÄĪļÖŹµÄĮæ“óÓŚĄķĀŪÖµ£¬Ö÷ŅŖŌŅņĪŖ_____________£ØÓĆ»Æѧ·½³ĢŹ½±ķŹ¾£©”£
¢ņ£®Öʱøäå£ŗ
ø»¼ÆäåµÄ¹ż³Ģ½įŹųŗ󣬼ĢŠųĻņ×°ÖĆ C ÖŠĶØČė Cl2£¬³ä·Ö·“Ó¦ŗóÕōĮó”£
£Ø4£©ĻĀĮŠÕōĮó×°ÖĆÕżČ·µÄŹĒ_____£ØĢīŃ”Ļī×ÖÄø£©”£

£Ø5£© ×°ÖĆ A ÖŠ¼ÓČėV mL ŗ¬ Br£µÄÅضČĪŖ c mol”¤L£1µÄÅØĖõŗ£Ė®£¬ÕōĮóĖłµĆäåµ„ÖŹµÄÖŹĮæĪŖ m g£¬ ŌņøĆŹµŃéÖŠäåµ„ÖŹµÄ²śĀŹĪŖ__________”£
”¾“š°ø”æ Čż¾±ÉÕĘæ 2Br££«Cl2£½Br2£«2Cl£ ½«Éś³ÉµÄ Br2“µČė×°ÖĆ C ÖŠ 1:1 2SO2£«O2£«2H2O£½2H2SO4 d ![]()
”¾½āĪö”æ£Ø1£©aµÄĆū³ĘĪŖČż¾±ÉÕĘ攣£Ø2£©²½Öč¢ŁÖŠÖ÷ŅŖ·“Ó¦ŹĒĀČĘųŃõ»ÆäåĄė×Ó£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Br££«Cl2£½Br2£«2Cl£”££Ø3£©äåŅ×»Ó·¢£¬Ņņ“Ė²½Öč¢ŚÖŠĶØČėČČæÕĘųµÄ×÷ÓĆĪŖ½«Éś³ÉµÄ Br2“µČė×°ÖĆCÖŠ”£×°ÖĆC ·¢Éśø»¼ÆäåµÄ·“Ó¦£ŗSO2+Br2+2H2O£½H2SO4+2HBr£¬ĘäÖŠSO2ŹĒ»¹Ō¼Į£¬äåŹĒŃõ»Æ¼Į£¬ĖłŅŌŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ1:1£»ÓÉÓŚSO2ŌŚČÜŅŗÖŠŅ×±»æÕĘųŃõ»Æ£¬ĖłŅŌŹµ¼Ź²Ī¼Ó·“Ó¦µÄSO2µÄĪļÖŹµÄĮæ“óÓŚĄķĀŪÖµ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2SO2£«O2£«2H2O£½2H2SO4”££Ø4£©ÕōĮóŹĒĪĀ¶Č¼ĘĖ®ŅųĒņ·ÅŌŚÉÕĘæÖ§¹Ü³öæŚ“¦£¬ĪŖ·ĄÖ¹ŅŗĢ岊ĮōŌŚĄäÄż¹ÜÖŠ£¬Ó¦øĆÓĆÖ±ŠĪĄäÄż¹Ü£¬“š°øŃ”d£»£Ø5£©×°ÖĆ A ÖŠ¼ÓČėV mLŗ¬ Br£µÄÅضČĪŖ c mol”¤L£1µÄÅØĖõŗ£Ė®£¬ÕōĮóĖłµĆäåµ„ÖŹµÄÖŹĮæĪŖm g£¬Ņņ“ĖøĆŹµŃéÖŠäåµ„ÖŹµÄ²śĀŹĪŖ![]() ”£
ӣ

 »„¶ÆÓ¢ÓļĻµĮŠ“š°ø
»„¶ÆÓ¢ÓļĻµĮŠ“š°ø ĆūÅĘѧŠ£·Ö²ćÖÜÖܲāĻµĮŠ“š°ø
ĆūÅĘѧŠ£·Ö²ćÖÜÖܲāĻµĮŠ“š°ø