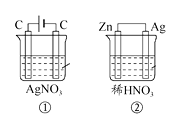
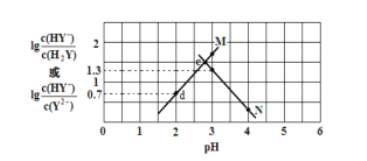
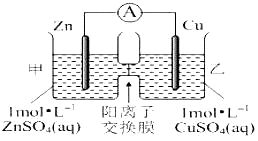
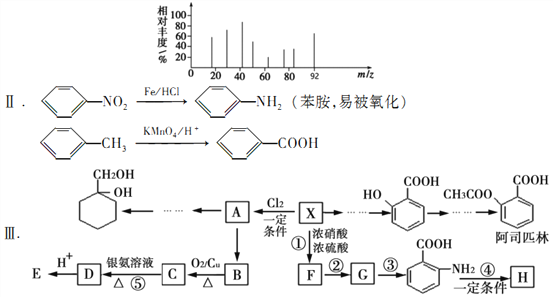
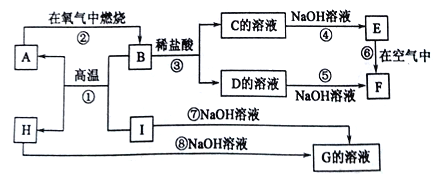
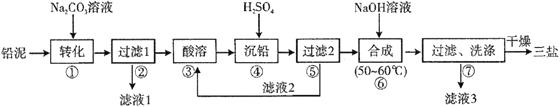
题目内容
【题目】下列变化过程中,需要加入还原剂才能实现的是( )
A.MnO2→MnO4-B.AlO2-→Al(OH)3
C.AsO33-→AsO43-D.MnO2→MnCl2
【答案】D
【解析】
A.MnO2→MnO4-的反应中,锰元素的化合价升高被氧化,需要加入氧化剂才能实现,故A错误;
B.A1O2-→Al(OH)3的反应中,化合价没有发生变化,不需要加入还原剂,故B错误;
C.AsO33-→AsO43-的反应中,As元素的化合价升高被氧化,需要加入氧化剂才能实现,故C错误;
D.MnO2→MnCl2的反应中,Mn元素的化合价降低被还原,需要加入还原剂才能实现,故D正确;
故选D。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为;继续滴加至液溴滴完。仪器a的名称是装置d中的作用是。仪器c为冷凝管,其进水口为(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是。
A.重结晶 B.过滤 C.蒸馏 D.萃取
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原