题目内容
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
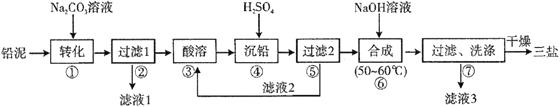
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________,该反应能发生的原因是__________________________。
(2)步骤②“过滤1”后所得滤渣的主要成分为__________________________。
(3)步骤③“酸溶”,最适合选用的酸为_________________,为提高酸溶速率,可采取的措施是___________________(任意写出一条)。
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1。
(5)从原子利用率的角度分析该流程的优点为_____________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_____%(结果保留一位小数)
【答案】 PbSO4+Na2CO3=PbCO3+Na2SO4 Ksp(PbSO4) > Ksp(PbCO3),容易实现沉淀的转化 Pb PbO PbCO3 HNO3 适当升温(适当增加硝酸浓度、减小滤渣颗粒大小等合理答案均可) 1×10-3 滤液2(HNO3溶液)可以循环利用 4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O+3Na2SO4+2H2O 51.8
3PbO·PbSO4·H2O+3Na2SO4+2H2O 51.8
【解析】(1)步骤①向铅泥中加Na2CO3溶液,由表可以知道PbCO3的溶解度小于PbSO4的溶解度,所以步骤①“转化”的化学方程式:PbSO4+Na2CO3=PbCO3+Na2SO4;该反应能发生的原因是Ksp(PbSO4) > Ksp(PbCO3),容易实现沉淀的转化;正确答案:PbSO4+Na2CO3=PbCO3+Na2SO4;Ksp(PbSO4)> Ksp(PbCO3),容易实现沉淀的转化。
(2)铅泥(主要成分为PbO、Pb及PbSO4等),加入碳酸钠溶液后,由于PbO、Pb与碳酸钠不反应,反应又生成了PbCO3,所以步骤②“过滤1”后所得滤渣的主要成分为Pb、PbO、PbCO3;正确答案:Pb、PbO、PbCO3。
(3)根据题给信息可知:铅与冷盐酸、冷硫酸几乎不起作用,所以步骤③“酸溶”,最适合选用的酸为硝酸;为提高酸溶速率,可采取的措施是适当升温或适当增加硝酸浓度或减小滤渣颗粒大小等;正确答案:HNO3 ;适当升温(适当增加硝酸浓度、减小滤渣颗粒大小等合理答案均可)。
(4)根据Ksp(PbSO4)=1.82×10-8,c(SO42-)×c(Pb2+)=1.82×10-8,c(Pb2+)=1.82×10-5mol·L-1,所以c(SO42-)=1×10-3 mol·L-1;正确答案:1×10-3。
(5)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2, Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,HNO3可循环利用;正确答案:滤液2(HNO3溶液)可以循环利用。
(6)硫酸铅与强碱溶液加热反应生成3PbO·PbSO4·H2O,化学方程式为4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O+3Na2SO4+2H2O ; 若得到纯净干燥的三盐
3PbO·PbSO4·H2O+3Na2SO4+2H2O ; 若得到纯净干燥的三盐![]() ,则其中铅元素的质量为:
,则其中铅元素的质量为:![]() ,设铅泥中铅元素的质量分数为w,则
,设铅泥中铅元素的质量分数为w,则![]() 铅泥中铅元素为
铅泥中铅元素为![]() ,铅泥中的铅元素有
,铅泥中的铅元素有![]() 转化为三盐,有
转化为三盐,有![]() ,计算得出,w=0.518=51.8%;正确答案:51.8。
,计算得出,w=0.518=51.8%;正确答案:51.8。

【题目】I.由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是________________________________________。
(3)四种金属活泼性由强到弱的顺序是______________________。
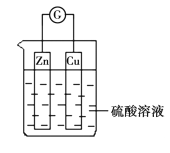
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。

(1)下列叙述正确的是________。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是________________________________________________________________________。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应________________________。