题目内容
【题目】完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____,属于电解质的是______,属于非电解质的_______。(用相应化学式填空)
下列关于③和⑦的说法正确的是____(填字母序号)。
a.都不稳定,密封静置会产生沉淀 b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为________;R元素名称是_______。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl)之比为____________ 。
【答案】SO2 BaCl2、KOH、CaO SO2、C2H5OH bc 7.1g 0.2 NA 14 氮 ![]() L 3:13 1:2:3
L 3:13 1:2:3
【解析】
(1)只能和碱反应生成盐和水的氧化物为酸性氧化物;在水溶液中或熔融状态下能导电的化合物为电解质,需要注意的是,氯化铁溶液虽然能导电,但属于混合物,所以既不是电解质,也不是非电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质。
a.溶液稳定,胶体具有介稳性;
b.胶体具有丁达尔效应,溶液没有丁达尔效应;
c.溶液与胶体的分散质粒子均可以透过滤纸,胶体的分散质粒子不能透过半透膜;
d.加入盐酸,氢氧化铁胶体先聚沉,后溶解。
(2)标准状况下,先求出2.24 L Cl2的物质的量,利用公式m=nM可求出质量;由Cl2的物质的量可求出氯原子数。
(3)先求出氧原子的物质的量,由此求出R2O5的物质的量、R2O5的相对分子质量,最后求出元素R的相对原子质量及名称。
(4)先求出a g某气体的体积,然后利用同一气体在相同条件下质量比等于体积比,求c g该气体在标准状况下的体积。
(5)由密度求混合气体的平均相对分子质量,然后设CH4和O2的物质的量分别为x、y,建立有关平均相对分子质量的计算式,求二者的体积比。
(6) NaCl、MgCl2、AlCl3的物质的量浓度相同,利用化学式,可求出三种溶液中c(Cl)之比。
(1)只能和碱反应生成盐和水的氧化物为酸性氧化物,故SO2为酸性氧化物;在水溶液中或熔融状态下能导电的化合物为电解质,故BaCl2、KOH、CaO为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质,故SO2、C2H5OH为非电解质。答案为:SO2;BaCl2、KOH、CaO;SO2、C2H5OH;
a.氯化铁溶液很稳定,氢氧化铁胶体具有介稳性,a错误;
b.氢氧化铁胶体具有丁达尔效应,氯化铁溶液没有丁达尔效应,b正确;
c.氯化铁溶液与氢氧化铁胶体的分散质粒子均可以透过滤纸,氢氧化铁胶体的分散质粒子不能透过半透膜,c正确;
d.加入盐酸,氢氧化铁胶体先聚沉,后溶解,氯化铁溶液无现象,d错误;
故选bc。
(2)标准状况下,2.24 L Cl2的物质的量为![]() =0.1mol,质量为0.1mol×71g/mol=7.1g;有0.1mol×2 NAmol-1=0.2 NA个氯原子。答案为:7.1g;0.2 NA;
=0.1mol,质量为0.1mol×71g/mol=7.1g;有0.1mol×2 NAmol-1=0.2 NA个氯原子。答案为:7.1g;0.2 NA;
(3)10.8g R2O5中氧原子的数目为3.01×1023,物质的量为![]() =0.5mol,则R2O5的相对分子质量为
=0.5mol,则R2O5的相对分子质量为![]() =108g/mol,元素R的相对原子质量为
=108g/mol,元素R的相对原子质量为![]() =14;R元素名称是氮。答案为:14;氮;
=14;R元素名称是氮。答案为:14;氮;
(4)a g某气体中含有的分子数为b,则其体积为![]() =
=![]() L,所以c g该气体在标准状况下的体积是
L,所以c g该气体在标准状况下的体积是![]() L=
L=![]() L。答案为:
L。答案为:![]() L;
L;
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍,则该混合气体的平均相对分子质量为14.5×2=29,设CH4和O2的物质的量分别为x、y,则![]() ,而求得x:y=3:13,故体积比为3:13。答案为:3:13;
,而求得x:y=3:13,故体积比为3:13。答案为:3:13;
(6) NaCl、MgCl2/span>、AlCl3的物质的量浓度相同,设为1mol/L,则三种溶液中c(Cl)之比为1mol/L:2mol/L:3mol/L=1:2:3。答案为:1:2:3。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
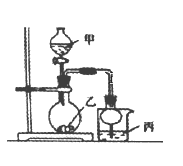
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 淀粉—KI溶液 | 溶液变蓝 |
C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
A.AB.BC.CD.D
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ![]() 探究1:验证同周期X、Y、Z三种元素金属性递变规律
探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Y剧烈 |
2、各取1.0g的金属Z和金属Y形状相同,分别加入到5mL 1.0mol/L盐酸中。 | 金属Y与盐酸反应比金属Z剧烈 |
(1)通过实验验证三种元素金属性由强到弱是_______________________,
(2)下列判断正确的是______
A.原子序数:![]()
![]() 原子的最外层电子数
原子的最外层电子数![]()
C.原子半径:X>Y>Z D. Z的最高价氧化物对应水化物的碱性最强
Ⅱ![]() 探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
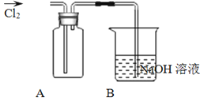
![]() 装置A中盛放的试剂是______
装置A中盛放的试剂是______![]() 填选项
填选项![]()
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
B中反应的离子方程式是__________________________________________________。
![]() 下列不能用于验证氯元素比硫元素非金属性强的依据为______
下列不能用于验证氯元素比硫元素非金属性强的依据为______![]() 填选项
填选项![]()
A.HCl酸性比![]() 强 B.HClO氧化性比
强 B.HClO氧化性比![]() 强
强
C.HClO3酸性比![]() 强 D.铁与
强 D.铁与![]() 反应生成
反应生成![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
![]() 若要验证非金属性:
若要验证非金属性:![]() ,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性
,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性![]() 的原因:同主族元素从上到下,____________________。
的原因:同主族元素从上到下,____________________。