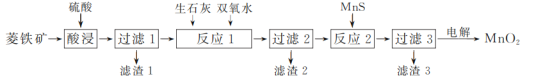
题目内容
【题目】气体A的产量可以衡量一个国家石油化工发展水平。如图是由A为原料生产B的转化关系图,B是一种有香味的液体。
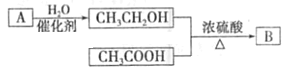
(1)将A通入溴水中,反应方程式__________________________(有机物写结构简式)观察到的实验现象是__________,A分子中官能团是_______。(写名称)
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_________________________,反应类型________
(3)1mol的乙酸与足量的乙醇反应,得到的乙酸乙酯66g,则产率为___________
(4)写出乙醇的一种用途:____________ ;乙烯的一种用途:________________
【答案】H2C=CH2+Br2→CH2BrCH2Br 溴水褪色,液体分层 碳碳双键 CH3CH2OH + CH3COOH![]() CH3CH2OOCCH3 + H2O 酯化反应 75% 燃料、医用酒精、酒业等 果实催熟剂、化工原料等
CH3CH2OOCCH3 + H2O 酯化反应 75% 燃料、医用酒精、酒业等 果实催熟剂、化工原料等
【解析】
乙烯、乙醇、乙酸等几种有机物的理化性质是高中必修化学需要掌握的重点内容。试题难度不大,但需要仔细审题,防止所答非所问。
常用乙烯的产量衡量一个国家石油化工发展水平,则气体A为乙烯(CH2=CH2)。图中在浓硫酸、加热条件下,CH3CH2OH、CH3COOH反应生成的有香味的液体B为乙酸乙酯(CH3COOCH2CH3)。
(1)A(CH2=CH2)通入溴水发生加成反应,化学方程式CH2=CH2+Br2→CH2BrCH2Br。生成物CH2BrCH2Br通常是不溶于水、密度比水大的无色液体,故实验现象为溴水褪色、液体分层。A分子中官能团是碳碳双键。
(2)在浓硫酸、加热条件下,CH3CH2OH与CH3COOH反应生成B,化学方程式CH3CH2OH + CH3COOH![]() CH3CH2OOCCH3 + H2O,反应类型为酯化反应(属于取代反应)。
CH3CH2OOCCH3 + H2O,反应类型为酯化反应(属于取代反应)。
(3)1mol乙酸与足量乙醇反应,理论上生成1mol乙酸乙酯(CH3COOCH2CH3,88g),而实际得到乙酸乙酯66g,则其产率为75%。
(4)乙醇可用于燃料、医用酒精、酒业等;乙烯用于果实催熟剂、化工原料等。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
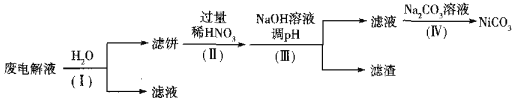
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。