题目内容
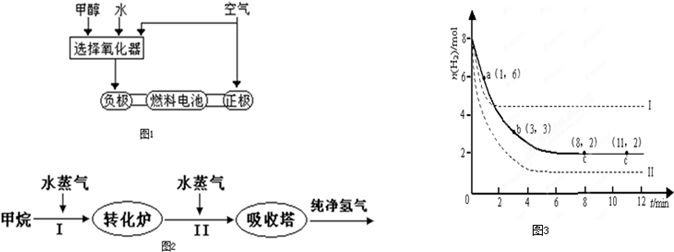
(7分)德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如右图所示,请观察此图回答: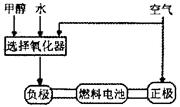
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=" +" 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
| A.反应①中反应物的总能量高于生成物的总能量 |
| B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g)中的化学键所释放的能量 |
| C.CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1 |
| D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1 |
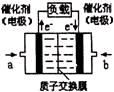
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如右图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是 ,负极反应为: 。
(1) BC D (2分)
(2)CO2(g)+ 3H2(g)= H2O(g)+CH3OH(g) △H=-49.47kJ/mol(2分)
(3)氧气或空气 1分 CH3OH+H2O-6e—=CO2+6H+ 2分
解析

练习册系列答案
相关题目
 德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答: