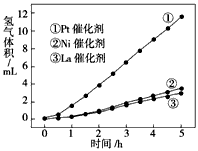
题目内容
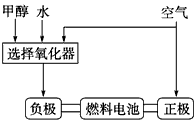
近来,制备和利用氢气这一清洁能源已有多项成果.(1)德国克莱斯公司成功研制了利用甲醇CH3OH)车载制氢燃料电池工艺,其原理如图1所示,请观察此图回答: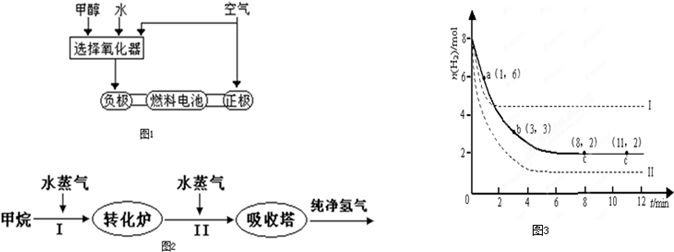
①此碱性燃料电池的正极反应式为
②甲醇与水反应制取氢气的化学方程式
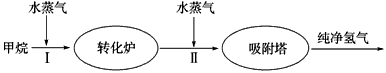
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
H2(g)+CO2(g),平衡常数随温度的变化如下表.
在830℃,n(CO)、n(H2O)、n(H2)、n(CO2)的物质的量分别是1、5、2、3投入恒容反应器发生上述反应,反应开始时,向
②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
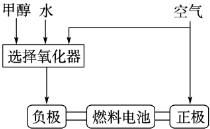
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
②求平衡时氢气的转化率
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是

①此碱性燃料电池的正极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;②甲醇与水反应制取氢气的化学方程式
CH3OH+H2O?3H2+CO2
CH3OH+H2O?3H2+CO2
.(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图2:
①此流程的第II步反应为:CO(g)+H2O(g)
| 高温 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
逆
逆
(填正、逆)反应方向进行.②若400℃时,第Ⅱ步反应生成l mol氢气放出的热量为33.2kJ,第I步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1 则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1
.(3)工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)
将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线).
①a点正反应速率
大于
大于
(填大于、等于或小于)逆反应速率.②求平衡时氢气的转化率
75%
75%
和该条件下反应的平衡常数K=0.5
0.5
.③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图3虚线所示,曲线I对应的实验条件改变是
升高温度
升高温度
,曲线II对应的实验条件改变是增大压强
增大压强
.分析:(1)①正极上是氧气得电子发生还原反应生成OH-;
②根据元素守恒甲醇与水反应制取氢气和二氧化碳;
(2)①根据Qc=
与K的大小关系判断;
②ⅠCO(g)+H2O(g)?H2(g)+CO2(g)△H=-33.2kJ?mol-1,
ⅡCH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1,
由盖斯定律可知,Ⅰ+Ⅱ得到CH4(g)2+H2O(g)=4H2(g)+CO2(g);
(3)①a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小;
②根据已知反应物的量,利用三段式,求出平衡时各物质的物质的量,再求转化率和平衡常数;
③从虚线变化判断达到平衡时反应物的转化的物质的量来分析,曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,曲线Ⅲ反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强.
②根据元素守恒甲醇与水反应制取氢气和二氧化碳;
(2)①根据Qc=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
②ⅠCO(g)+H2O(g)?H2(g)+CO2(g)△H=-33.2kJ?mol-1,
ⅡCH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1,
由盖斯定律可知,Ⅰ+Ⅱ得到CH4(g)2+H2O(g)=4H2(g)+CO2(g);
(3)①a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小;
②根据已知反应物的量,利用三段式,求出平衡时各物质的物质的量,再求转化率和平衡常数;
③从虚线变化判断达到平衡时反应物的转化的物质的量来分析,曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,曲线Ⅲ反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强.
解答:解:(1)①正极上是氧气得电子发生还原反应生成OH-其电极反应方程为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②甲醇与水反应制取氢气和二氧化碳,其反应方程为:CH3OH+H2O?3H2+CO2,故答案为:CH3OH+H2O?3H2+CO2;
(2)①Qc=
=
=1.2>K=1,所以平衡逆移,故答案为:逆;
②ⅠCO(g)+H2O(g)?H2(g)+CO2(g)△H=-33.2kJ?mol-1,
ⅡCH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1,
由盖斯定律可知,Ⅰ+Ⅱ得到CH4(g)2+H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ?mol-1,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1;
(3)①(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,故答案为:大于;
②设参加反应的二氧化碳为nmol;
CO2(g)+3H2(g)
CH3OH(g)+H2O
起始的量:6mol 8mol
反应的量:n 3n n n
平衡的量:6-n 8-3n n n
已知平衡时:氢气的物质的量为2mol,所以8-3n=2,即n=2mol,所以CO2、H2、CH3OH、H2O的浓度分别为:2mol/L,1mol/L,1mol/L,1mol/L;
所以平衡时氢气的转化率为:
×100%=75%,K=
=
=0.5,
故答案为:75%;0.5;
③曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强,故答案为:升高温度;增大压强.
②甲醇与水反应制取氢气和二氧化碳,其反应方程为:CH3OH+H2O?3H2+CO2,故答案为:CH3OH+H2O?3H2+CO2;
(2)①Qc=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| ||||
|
②ⅠCO(g)+H2O(g)?H2(g)+CO2(g)△H=-33.2kJ?mol-1,
ⅡCH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1,
由盖斯定律可知,Ⅰ+Ⅱ得到CH4(g)2+H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ?mol-1,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1;
(3)①(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,故答案为:大于;
②设参加反应的二氧化碳为nmol;
CO2(g)+3H2(g)
起始的量:6mol 8mol
反应的量:n 3n n n
平衡的量:6-n 8-3n n n
已知平衡时:氢气的物质的量为2mol,所以8-3n=2,即n=2mol,所以CO2、H2、CH3OH、H2O的浓度分别为:2mol/L,1mol/L,1mol/L,1mol/L;
所以平衡时氢气的转化率为:
| 2×3mol |
| 8mol |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 1×1 |
| 2×13 |
故答案为:75%;0.5;
③曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强,故答案为:升高温度;增大压强.
点评:此题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.

练习册系列答案
相关题目
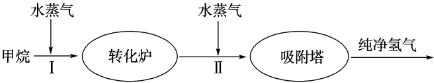
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=