题目内容
近来,制备和利用氢气这一清洁能源已有多项成果.
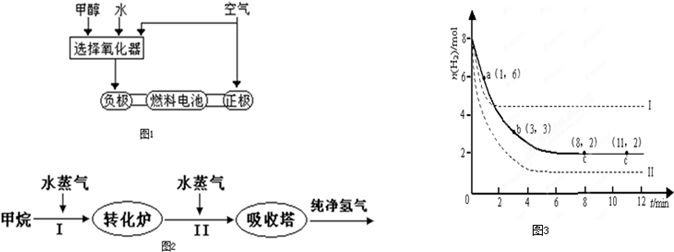
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如图所示,请观察此图回答:
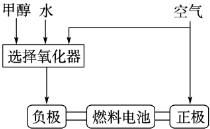
①燃料电池的正极反应式为 ;
②甲醇与流程图中任一反应物反应制取氢气的化学方程式 .
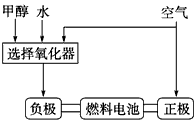
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
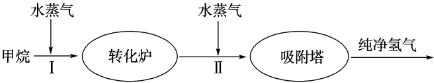
①此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;
②此流程的第Ⅱ步反应的平衡常数随温度的变化如表1,在830℃,以表2的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
表1
表2
③若400℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2(单位为kJ),第1步反应的热化学方程式为:
CH4(g)+H2O(g)═3H2(g)+CO(g)△H=-103.3kJ?mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 .
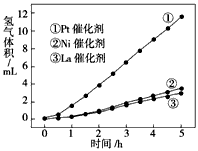
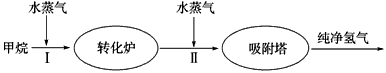
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,如图是三种催化剂在光照分解水实验中的效果比较图.能得出如图结果的实验方案是 .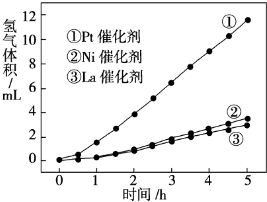
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如图所示,请观察此图回答:

①燃料电池的正极反应式为
②甲醇与流程图中任一反应物反应制取氢气的化学方程式
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如表1,在830℃,以表2的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
表1
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
CH4(g)+H2O(g)═3H2(g)+CO(g)△H=-103.3kJ?mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,如图是三种催化剂在光照分解水实验中的效果比较图.能得出如图结果的实验方案是

分析:(1)①原电池正极上氧气得电子发生还原反应;
②甲醇可以和水反应生成氢气,也可以和氧气反应放出氢气;
(2)①根据反应方程式和平衡常数的含义书写平衡常数表达式;
②已知830℃时的平衡常数为1,根据表中数据求出浓度商,再与K比较,若浓度商大于K,则逆向移动,若浓度商小于K,则正向移动;
③根据已知热化学方程式和利用盖斯定律计算书写;
(3)控制其它条件相同,改变催化剂.
②甲醇可以和水反应生成氢气,也可以和氧气反应放出氢气;
(2)①根据反应方程式和平衡常数的含义书写平衡常数表达式;
②已知830℃时的平衡常数为1,根据表中数据求出浓度商,再与K比较,若浓度商大于K,则逆向移动,若浓度商小于K,则正向移动;
③根据已知热化学方程式和利用盖斯定律计算书写;
(3)控制其它条件相同,改变催化剂.
解答:解:(1)①原电池正极上氧气得电子发生还原反应,生成氢氧根离子,其电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
②甲醇可以和水反应生成氢气,也可以和氧气反应放出氢气,其反应的化学方程式为:CH3OH+H2O=CO2+3H2或2CH3OH+O2=2CO2+4H2,
故答案为:CH3OH+H2O=CO2+3H2或2CH3OH+O2=2CO2+4H2;
(2)①已知CO(g)+H2O(g)?H2(g)+CO2(g),则化学平衡常数K=
;故答案为:
;
②A、QA=
=
=1.2>1=K,所以反应向逆方向进行,故A不符合;
B、QB=
=
=0.25<1=K,反应未达到平衡,所以反应向正方向进行,故B符合;
C、QC=
=0<1=K,反应未达到平衡,所以反应向正方向进行,故C符合;
D、QD=
=
=1,反应处于平衡状态,故D不符合;
故答案为:BC;
③由题意知CO(g)+H2O(g)=H2(g)+CO2(g)△H=-33.2 kJ?mol-1
又有CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ?mol-1
两方程式相加得CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1;
(3)比较不同催化剂的催化效果需要其他条件相同,然后每小时测定一次不同催化剂分解水产生氢气的体积,记录数据,作图分析;
故答案为:控制其他条件不变,每小时测定一次不同催化剂分解水产生氢气的体积,记录数据,作图分析.
故答案为:O2+2H2O+4e-=4OH-;
②甲醇可以和水反应生成氢气,也可以和氧气反应放出氢气,其反应的化学方程式为:CH3OH+H2O=CO2+3H2或2CH3OH+O2=2CO2+4H2,
故答案为:CH3OH+H2O=CO2+3H2或2CH3OH+O2=2CO2+4H2;
(2)①已知CO(g)+H2O(g)?H2(g)+CO2(g),则化学平衡常数K=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
②A、QA=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 3×2 |
| 5×1 |
B、QB=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 1×1 |
| 2×2 |
C、QC=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
D、QD=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 1×1 |
| 2×0.5 |
故答案为:BC;
③由题意知CO(g)+H2O(g)=H2(g)+CO2(g)△H=-33.2 kJ?mol-1
又有CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ?mol-1
两方程式相加得CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=-136.5kJ?mol-1;
(3)比较不同催化剂的催化效果需要其他条件相同,然后每小时测定一次不同催化剂分解水产生氢气的体积,记录数据,作图分析;
故答案为:控制其他条件不变,每小时测定一次不同催化剂分解水产生氢气的体积,记录数据,作图分析.
点评:本题考查了电极方程式的书写,化学方程式的书写,反应方向的判断,热化学方程式的书写等;属于反应原理的应用的考查,题目难度中等;注意对反应原理的归纳整理,熟练掌握有关的原理是解题的关键.

练习册系列答案
相关题目
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=