题目内容
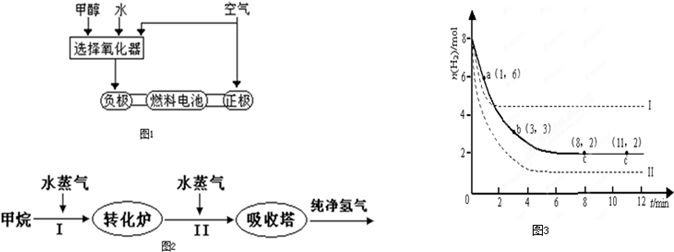
(7分)德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如右图所示,请观察此图回答:

(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= + 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
A.反应①中反应物的总能量高于生成物的总能量
B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g) 中的化学键所释放的能量
C.CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1
D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5 kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如右图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是 ,负极反应为: 。

(1) BC D (2分)
(2)CO2(g)+ 3H2(g)= H2O(g)+CH3OH(g) △H=-49.47kJ/mol(2分)
(3)氧气或空气 1分 CH3OH+H2O-6e—=CO2+6H+ 2分
【解析】

 德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答: