题目内容
NA代表阿伏加德罗常数。下列叙述正确的是
| A.标准状况下,22.4L己烷中C-C共价键数目为5NA |
| B.0.1mol·L¯1AlCl3溶液中含有氯离子数为0.3NA |
| C.1molFe在1molCl2中充分燃烧,转移电子数为3NA |
| D.20g重水(2 1H2O)所含的电子数为10NA |
D
解析试题分析:已烷是含有6个碳原子的烷烃,结构简式为CH3CH2CH2CH2CH2CH3,在标准状况下是液体,不能用公式n=V÷22.4L/mol,其物质的量不是1mol,所含C—C键也不是5mol,故A错误;虽然n=c?V,但是溶液体积未知,不能确定AlCl3的物质的量,因此也不能确定所含氯离子的物质的量,故B错误;2Fe+3Cl2 2FeCl3~6eˉ,由于系数之比等于物质的量之比,由此推断氯气不足、铁过量,应根据完全反应的物质求转移的电子,则1mol Cl2与过量铁完全反应转移2mol电子,故C错误;重水的相对分子质量为2×2+16=20,由于n=m/M,则重水为1mol,由于1个2 1H2O分子含有(1×2+8)个电字,则1mol2 1H2O中含有10mol电子,故D正确。
2FeCl3~6eˉ,由于系数之比等于物质的量之比,由此推断氯气不足、铁过量,应根据完全反应的物质求转移的电子,则1mol Cl2与过量铁完全反应转移2mol电子,故C错误;重水的相对分子质量为2×2+16=20,由于n=m/M,则重水为1mol,由于1个2 1H2O分子含有(1×2+8)个电字,则1mol2 1H2O中含有10mol电子,故D正确。
考点:考查阿伏加德罗常数,涉及物质的状态、物质的组成和结构、过量问题判断、氧化还原反应中转移电子数、体积、物质的量浓度、质量、摩尔质量、物质的量等。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值。下列叙述错误的是
| A.常温常压下,0.17g NH3中含有的共用电子对数为0.1NA |
| B.常温常压下,1 L pH=1的稀H2SO4中含有的氢离子数为0.1NA |
| C.标准状况下,2.24 L C12与足量稀NaOH反应转移电子数为0.1NA |
| D.10 g由CaCO3与KHCO3组成的混合物中含有的碳原子数为0.1NA |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
| A.标准状况下,44.8L NO与22.4L O2混合气体中分子总数等于3NA |
| B.Al2(SO4)3溶液中还可以大量存在Na+、K+、CO2—3、NO—3 |
| C.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO—+SO2+H2O=CaSO3+2HClO |
| D.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.39g苯分子中含有的碳碳双键数为1.5NA |
| B.1molCH3COONa和少量CH3COOH溶于水所得中性溶液中,CH3COO-数目为NA |
| C.2.24LNH3中含共价键数目一定为0.3NA |
| D.5.6gFe投入100mL 3.5mol·L-1稀硝酸中,充分反应,转移电子总数为0.3 NA |
设NA为阿伏加德罗常数的数值,则下列叙述正确的是
| A.1 mol氨基(—NH2)中含电子数为10NA |
| B.标准状况下,2.24 L18O2中所含中子的数目是2NA |
| C.标准状况下,22.4 L C8H18中含有的共价键键数为25NA |
| D.在反应CaO + 3C = CaC2 + CO↑中,每生成1 mol CO,转移的电子数为3NA |
设NA代表阿伏加德罗常数。下列叙述正确的是
| A.标准状况下2.24 L H2O中,分子数为0.1NA |
| B.1 L 0.5mol·L-1 AlCl3溶液中含有的Al3+ 数为0.5 NA |
| C.常温常压下16g O2中,氧原子数为NA |
| D.0.1mol 铁粉与足量的盐酸充分反应,转移的电子数为0.3NA |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.常温常压下,4.4g CO2和4.4g N2O的原子总数都是0.3NA |
| B.次氯酸光照分解产生22.4mL气体(标准状况下),转移电子数为0.002NA |
| C.常温下,4.6g乙醇含有C—H键总数为0.6 NA |
| D.0.2 mol·L-1 FeCl3溶液中含有Cl-总数为0.6NA |
NA代表阿伏加德罗常数的数值。下列有关NA的叙述中,正确的是
| A.1 mol 任何物质所含的分子数均为NA个 |
| B.14 g氮气所含的N原子数为NA个 |
| C.标准状况下,22.4 L水所含的H2O分子数为NA个 |
| D.在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |
有关化学用语表达正确的是
A.聚丙烯的结构简式: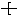 CH2-CH2-CH2 CH2-CH2-CH2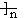 |
B.C1-的结构示意图: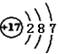 |
| C.102 46Pd和103 46Pd互为同位素 |
D.过氧化氢电子式: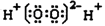 |