题目内容
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
| A.标准状况下,44.8L NO与22.4L O2混合气体中分子总数等于3NA |
| B.Al2(SO4)3溶液中还可以大量存在Na+、K+、CO2—3、NO—3 |
| C.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO—+SO2+H2O=CaSO3+2HClO |
| D.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
D
解析试题分析:A、标准状况下,44.8L NO与22.4L O2混合气体恰好反应生成44.8LNO2,物质的量是44.8L÷22.4L/mol=2mol。又因为NO2与N2O4存在化学平衡2NO2 N2O4,因此分子总数小于2NA,A不正确;B、Al3+与CO32-水解相互促进,生成氢氧化铝和CO2,不能大量共存,B不正确;C、次氯酸钙具有强氧化性,SO2具有还原性,二者发生氧化还原反应生成硫酸钙和氯化氢,C不正确;D、钠在反应中失去1个电子,2.3g钠是0.1mol,与氧气反应时无论加热与否转移电子数均为0.1NA,D正确,答案选D。
N2O4,因此分子总数小于2NA,A不正确;B、Al3+与CO32-水解相互促进,生成氢氧化铝和CO2,不能大量共存,B不正确;C、次氯酸钙具有强氧化性,SO2具有还原性,二者发生氧化还原反应生成硫酸钙和氯化氢,C不正确;D、钠在反应中失去1个电子,2.3g钠是0.1mol,与氧气反应时无论加热与否转移电子数均为0.1NA,D正确,答案选D。
考点:考查物质的量和氧化还原反应的有关计算;离子共存等

练习册系列答案
相关题目
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、 |
C. 、 、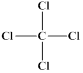 | D. 、1s22s22p63s23p6 、1s22s22p63s23p6 |
用NA表示阿伏加德罗常数,下列结论能够成立的是
| A.2L0.1mol/L的NaCO3溶液中含有CO32-的个数是0.2NA |
| B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA |
| C.0.2mol/LCuSO4溶液加水稀释至体积增加l倍,其浓度变为0.1mol/L |
| D.常温下pH=5的H2SO3水溶液中c(H+):c(SO32-)=2:1 |
NA代表阿伏加德罗常数,下列说法正确的是:( )
| A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
B.已知2CO(g)+O2(g)  2CO2(g);△H=-akJ﹒mol-1将2NA个CO与NA个O2混合充分反应放出akJ的热量。 2CO2(g);△H=-akJ﹒mol-1将2NA个CO与NA个O2混合充分反应放出akJ的热量。 |
| C.用石灰乳完全吸收l mol Cl2时,转移电子的数目是NA |
| D.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA |
称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
| A.2∶3 | B.1∶6 | C.3∶2 | D.1∶1 |
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
| A.1L0.1mol·L-1的氨水中含有的NH3分子数为0.1NA |
| B.标准状况下,2. 24L的CCl4中含有的C-Cl键数为0.4NA |
| C.常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
| D.标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
一定量的锌与100mL18.5mol?L﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol?L﹣1.则生成的气体中SO2和H2的体积比为( )
| A.1:2 | B.2:1 | C.1:4 | D.4:1 |
NA代表阿伏加德罗常数。下列叙述正确的是
| A.标准状况下,22.4L己烷中C-C共价键数目为5NA |
| B.0.1mol·L¯1AlCl3溶液中含有氯离子数为0.3NA |
| C.1molFe在1molCl2中充分燃烧,转移电子数为3NA |
| D.20g重水(2 1H2O)所含的电子数为10NA |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.通常情况下,7.6g CS2含有非极性键数目为0.4NA |
| B.22.4L CO气体与1mol N2所含的电子数相等 |
| C.将7.8gNa2O2放入足量的水中,反应时转移0.1NA电子 |
| D.25℃时,1L pH=13的Ba(OH)2溶液中含OH—数目为0.2NA |