题目内容
2.(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1.(2)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
C3H8(g)+5O2(g)=4H2O(l)+3CO2(g) H=-2220.0kJ/mol
实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为1:2.
(4)反应2A?B+C,在某一温度时,达到平衡.若温度升高,化学平衡正向移动,则正反应是吸热反应;若B是固体,降低压强时,平衡逆向移动,则A是气态;若A是气态,加压时,平衡不移动,则B为气态,C为气态.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)先根据方程式求出H2和C3H8的燃烧热,然后设出H2的物质的量,利用方程式组来解;
(4)温度升高,平衡向吸热反应方向移动;降低压强平衡向气体体积增大的方向移动,据此判断;增大化学平衡不移动,反应前后气体的物质的量相等,据此判断.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.8KJ,所以甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1molN三N键共吸收的能量为3×436kJ+946kJ=2254kJ,生成2molNH3,共形成6molN-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346kJ-2254kJ=92kJ,N2与H2反应生成NH3的热化学方程式为,N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(3)设混合气中CH4的物质的量为x,则C3H8的物质的量为1mol-x.根据题意,列方程为:
890kJ/mol×x+2220.0kJ/mol×(1mol-x)=1776.7kJ,
解得 x=0.33mol;C3H8的物质的量为1mol-0.33mol=0.67mol.
所以混合气体中H2与C3H8的体积比即物质的量之比为0.33:0.67≈1:2.故答案为:1:2;
(4)温度升高,平衡向正反应方向移动,由于温度升高,平衡向吸热反应方向移动,故正反应为吸热反应,
B为固体,降低压强平衡向逆反应方向移动,由于降低压强平衡向气体体积增大的方向移动,故逆反应为气体体积增大的反应,故A为气态;
增大化学平衡不移动,反应前后气体的物质的量相等,A是气态时,则B为气态,C为气态,
故答案为:吸;气;气;气.
点评 本题考查化学平衡的影响因素,热化学方程式书写,键能计算反应焓变,难度不大,注意压强对平衡移动的影响.掌握基础是关键.

| A. | 在镍做催化剂的条件下,苯与氢气反应 | |
| B. | 苯与液溴混合后加入铁粉 | |
| C. | 乙烯通入溴水中 | |
| D. | 烧至红热的铜丝插入乙醇中 |
| A. | 1 mol Fe与过量的稀HNO3反应,转移2 NA个电子 | |
| B. | 常温常压下,22.4L的NO2和CO2合气体含有2 NA个O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA个HCO3- | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
| 物质 | M | N | P | Q |
| 反应前质量(g) | 15.8 | 8.4 | 31.6 | 1.6 |
| 一段时间后质量(g) | 待测 | 14 | 21.6 | 6 |
| A. | 该反应类型属置换反应 | B. | 物质P一定是化合物 | ||
| C. | 反应生成的N与Q的质量比为7:3 | D. | M肯定为该反应的催化剂 |
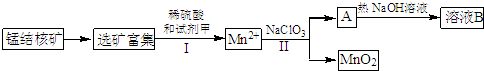
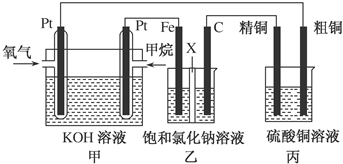
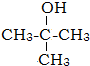 .
.
