题目内容
7.为了测定有机物A的结构,习同学做如下实验:①去7.4g该有机物完全燃烧,生成0.4molCO2和9.0g水
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③该化合物的核磁共振氢谱如图二,两个峰的面积之比是1:9
试回答下列问题:
(1)有机物A的相对分子质量是74
(2)综合上述信息写出有机物A的结构简式
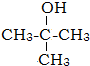 .
.(3)请用系统命名法对有机物A命名2-甲基-2-丙醇.

分析 (1)根据图一所示的质谱图判断其相对分子质量;
(2)根据质量守恒定律确定该有机物分子式,然后结合其性质判断其结构简式;
(3)根据该有机物的结构简式及有机物命名原则写出其名称.
解答 解:(1)根据图一所示的质谱图可知,其最大质核比为74,则该有机物的相对分子质量为74,
故答案为:74;
(2)7.4g该有机物的物质的量为:$\frac{7.4g}{74g/mol}$=0.1mol,0.1mol该有机物完全燃烧生成0.4molCO2和9.0g水,根据质量守恒,该有机物分子中含有C原子数为:$\frac{0.4mol}{0.1mol}$=4,9.0g水的物质的量为:$\frac{9.0g}{18g/mol}$=0.5mol,该有机物分子中含有H的原子数为:$\frac{0.5mol×2}{0.1mol}$=10,
4个C、10个H原子的总原子量为:12×4+1×10=58<74,说明该有机物分子中含有O原子,含有氧原子数目为:$\frac{74-58}{16}$=1,
所以该有机物分子式为:C4H10O,
根据图二及两个峰的面积之比是1:9可知,该有机物分子中含有3个甲基和1个羟基,其结构简式为: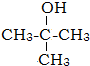 ,
,
故答案为: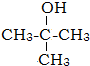 ;
;
(3)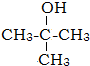 为醇类,主链为丙醇,羟基在2号C,其名称为:2-甲基-2-丙醇,
为醇类,主链为丙醇,羟基在2号C,其名称为:2-甲基-2-丙醇,
故答案为:2-甲基-2-丙醇.
点评 本题考查了常见有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,明确常见有机物结构及命名原则,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
15.常温下,下列有关叙述正确的是( )
| A. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三溶液中,c(NH4+)大小顺序为:①>②>③ | |
| B. | Na2CO3溶液中,2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| D. | 10 mL pH=12NaOH溶液中加入pH=2的HA溶液至pH刚好等于7,则溶液体积V(总)=20 mL |
12.下列由相关实验现象所推出的结论正确的是( )
| A. | Al与稀H2SO4、稀HNO3反应均生成铝盐并放出气体,说明Al与两种酸均发生置换反应 | |
| B. | 常温下浓硫酸能使铁和铝发生钝化,于是可在常温下用铁或铝制品贮藏、贮运浓硫酸 | |
| C. | Cl2和SO2均能使品红溶液褪色,说明二者都有氧化性 | |
| D. | 向溶液中滴加硝酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42-或SO32-中的一种或两种 |
16.镁,锌合金粉末7.7g恰好与一定质量20%的稀硫酸完全反应,将反应后的溶液蒸发,经处理后得到不含结晶水的固体22.1g,则反应中生成氢气的质量为( )
| A. | 0.1g | B. | 0.2g | C. | 0.3g | D. | 无法计算 |
17.下列反应不能用离子方程式:CO32-+2H+═CO2↑+H2O表示的是( )
| A. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | B. | (NH4)2CO3+2HCl═2NH4Cl+H2O+CO2↑ | ||
| C. | K2CO3+H2SO4═K2SO4+CO2↑+H2O | D. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O |

 .
. .
. .
.