题目内容
【题目】Ag2O—Zn纽扣电池的固体拆解物中含Ag2O、Ag、Zn、Cu、石墨等物质,从中可提取金属银。如图是简要生产流程。
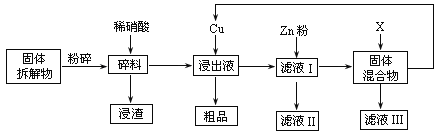
(1)固体拆解物需先粉碎的目的是___。
(2)浸渣的主要成分是___。
(3)以上流程中可循环使用的物质是___,除此之外,你认为通过对___(填流程图中的物质代号)的回收处理,还有可能实现___(填化学式)的循环利用。
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是___(用离子方程式表示).
(5)有人在实验室中利用如下方案回收银:

已知:Ag++2NH3![]() [Ag(NH3)2]+ K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+ K稳=1.7×107;Ksp(AgCl)=1.8×10-10
写出AgCl(s)与NH3反应的离子方程式___,该反应的平衡常数K=___。
(6)上述两种回收方案中都用到了试剂X,X是___。
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag___g(列出计算式,已知1个电子所带电量为1.6×10-19C,阿伏伽德罗常数的值用NA表示)。
【答案】增加酸浸速率,提高浸取率 石墨 Cu 滤液Ⅱ、Ⅲ Zn ![]() AgCl+2NH3
AgCl+2NH3![]() [Ag(NH3)2]++Cl- 3.06×10-3 A
[Ag(NH3)2]++Cl- 3.06×10-3 A ![]()
【解析】
(1)粉碎是为了更好的酸浸,所以目的是增大接触面积,加快酸浸速率,
故答案为:增加酸浸速率,提高浸取率;
(2)石墨不与稀硝酸反应,故滤渣为石墨,
故答案为:石墨;
(3)根据流程图知,固体混合物中含铜,回收可参与循环利用,而滤液Ⅱ、Ⅲ中均含有Zn2+,可回收加以循环利用,
故答案为:Cu;滤液Ⅱ、Ⅲ;Zn;
(4)加入Cu之前,若酸性太强,Cu与稀硝酸发生氧化还原反应,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(5)由信息可得,AgCl溶于NH3的离子方程式为AgCl+2NH3![]() [Ag(NH3)2]++Cl-;该反应的平衡常数为
[Ag(NH3)2]++Cl-;该反应的平衡常数为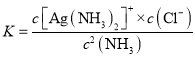 =
= =K稳×Ksp=1.7×107×1.8×10-10=3.06×10-3,
=K稳×Ksp=1.7×107×1.8×10-10=3.06×10-3,
故答案为:AgCl+2NH3![]() [Ag(NH3)2]++Cl-;3.06×10-3;
[Ag(NH3)2]++Cl-;3.06×10-3;
(6)第一种回收方法中,固体混合物与X反应后,生成物中有铜,在固体混合物中含Zn和Cu,要回收Cu,可利用稀硫酸和CuSO4溶液,而第二种方法中,在固体混合物中含Zn和Ag,若要除去Zn,则只能利用稀硫酸,故符合题意的为A,
故答案为:A;
(7)1h=3600s,Q=It=y×3600,根据题意回收的Ag的质量=![]() g,
g,
故答案为:![]() 。
。