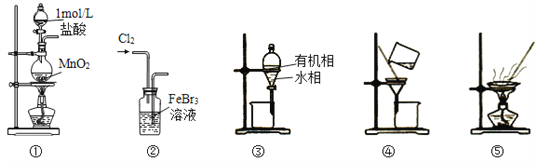
题目内容
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g) → CH4(g)+ C2H2(g) + H2(g) △H1= +156.6 kJ/mol
②C3H6(g) → CH4(g) + C2H2(g ) △H2= +32.4 kJ/mol
则相同条件下,反应C3H8(g) → C3H6(g) + H2(g)的△H=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是KOH溶液。则燃料电池的负极反应式为_________________。
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则该溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”、“<”),原因是_____________(用离子方程式和必要的文字说明)。
(4)常温下,请写出0.1 mol/LNa2CO3溶液中的各离子浓度大小关系式:_______ ;
【答案】+124.2 ![]() > HCO3既能水解又能电离:
> HCO3既能水解又能电离:![]() ;
;![]() ,而0.1mol/LNaHCO3溶液的pH大于8,溶液显碱性,说明HCO3的水解程度大于其电离程度,故水解出的c(H2CO3)大于电离出的c(CO32)
,而0.1mol/LNaHCO3溶液的pH大于8,溶液显碱性,说明HCO3的水解程度大于其电离程度,故水解出的c(H2CO3)大于电离出的c(CO32) ![]()
【解析】
(1)依据热化学方程式和盖斯定律计算得到;
(2)丙烷燃料电池,该电池的电解质溶液为KOH溶液,燃料在负极失电子发生氧化反应,氧气再正极得到电子发生还原反应,注意电解质溶液为碱溶液的环境;
(3)HCO3-既能电离显酸性又能水解显碱性,而现在NaHCO3溶液的pH大于8,说明HCO3-的水解程度大于其电离程度,据此分析;
(4)Na2CO3为强碱弱酸盐,CO32-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小。
(1) ![]()
![]()
依据盖斯定律①②得到![]() ,故答案为:+124.2;
,故答案为:+124.2;
(2)丙烷燃料电池,该电池的电解质溶液为KOH溶液,燃料丙烷在负极失电子发生氧化反应,电极反应为:![]() ;
;
(3)HCO3既能电离显酸性又能水解显碱性,而NaHCO3溶液的pH大于8,说明HCO3的水解程度大于其电离程度:![]() ;
;![]() ;故水解出的c(H2CO3)大于电离出的c(CO32);
;故水解出的c(H2CO3)大于电离出的c(CO32);
(4)Na2CO3为强碱弱酸盐,CO32水解导致溶液呈碱性,溶液中物质的行为:![]() ;
;![]() ;
;![]() ;
;![]() ;
;
根据盐的水解程度很小可知:溶液中离子浓度大小顺序是![]() 。
。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
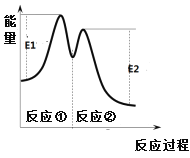
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0