题目内容
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是( )
| A.C(Na+)>C(CN—)>C( H+)>C(OH―) | B.C(HCN)+C (CN—)=0.04mol·L—1 |
| C.C(Na+)+C(H+)= C(CN—)+C(OH―) | D.C(CN—)>C(HCN) |
C
解析试题分析:根据题意可知等浓度、等体积的NaCN、HCN的混合溶液中,C(CN—)<C(Na+),说明NaCN的水解作用大于HCN的电离作用,水解消耗水电离产生的H+,所以溶液显碱性,C(OH―)>C( H+),所以选项A错误;C(HCN)+C (CN—)=(0.02mol/L×1L+0.02mol/L×1L)÷2L=0.02mol/L,所以选项B错误;C.根据电荷守恒可得:C(Na+)+C(H+)= C(CN—)+C(OH―)。正确;D.由于NaCN、HCN是等浓度、等体积混合,所以若不水解、不电离,则C(CN—)="C(HCN)=" C(Na+),但是由于反应后C(CN—)< C(Na+),说明CN—水解产生了HCN,所以C(CN—)<C(HCN),选项D错误。
考点:考查溶液中离子浓度的大小比较的知识。

练习册系列答案
相关题目
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中
2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O
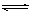 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6D.向上述NaClO 溶液中通HF气体至恰好完全反应时:
c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
下列说法正确的是( )
A.草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中:c(C2O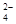 )>c(H2C2O4) )>c(H2C2O4) |
B.在小苏打水溶液中:c(Na+)+c(H+)=c(HCO )+c(CO )+c(CO )+c(OH-) )+c(OH-) |
| C.相同温度下,1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比是2:1 |
D.当氨水与盐酸恰好完全反应时,c(NH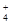 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
在100mL1.0×10-4mol/L的KCl溶液中,加入100mL2.0×10-6mol/L的AgNO3溶液,下列说法正确的是( )
| A.有AgCI沉淀生成 | B.无AgCI沉淀生成 | C.有沉淀生成但不是AgCI | D.无法确定 |
NH4Cl溶液中的离子浓度大小关系正确的是
A. | B. |
C.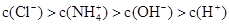 | D. |
下列过程表达式中,属于电离方程式的是
A.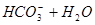  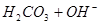 | B.  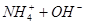 |
C.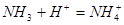 | D.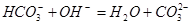 |
下列说法正确的是
| A.向蒸馏水中滴加浓H2SO4时,KW不变 |
| B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12 |
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3+ 2OH- H2CO3+ 2OH- |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
在100mL0.1mol/L醋酸溶液中加入以下物质中的一种,醋酸溶液pH变小。所加入的这种物质是
| A.水 | B.0.1mol/L盐酸 |
| C.醋酸钠晶体 | D.0.1mol/L氢氧化钠溶液 |