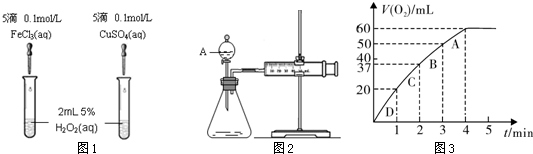
题目内容
NH4Cl溶液中的离子浓度大小关系正确的是
A. | B. |
C.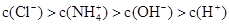 | D. |
D
解析试题分析:根据电荷守恒可知c(NH4+)+c(H+)=c(OH-)+c(Cl-)。由于铵根离子水解消耗水电离产生的OH-,所以c(H+)>c(OH-);c(Cl-) > c(NH4+),但是盐的水解程度是微弱的,盐的电离远大于弱电解质水的电离,因此c(NH4+)> c(H+)。故离子浓度关系是c(Cl-) > c(NH4+) >c(H+)>c(OH-)。选项是D。
考点:考查盐的水解、溶液中离子浓度的大小比较的知识。

练习册系列答案
相关题目
常温下,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b |
25℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
| A.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是( )
| A.C(Na+)>C(CN—)>C( H+)>C(OH―) | B.C(HCN)+C (CN—)=0.04mol·L—1 |
| C.C(Na+)+C(H+)= C(CN—)+C(OH―) | D.C(CN—)>C(HCN) |
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下列有关水的叙述正确的是
| A.水是一种非电解质 |
| B.纯水中c(H+)随着温度的升高而降低 |
| C.由液态水结成冰的过程是一个熵增的过程 |
| D.25℃,pH相同的氢氧化钠溶液与醋酸钠溶液,水的电离度前者小于后者 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0molL-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |