题目内容
下列说法正确的是
| A.向蒸馏水中滴加浓H2SO4时,KW不变 |
| B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12 |
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3+ 2OH- H2CO3+ 2OH- |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
B
解析试题分析:A项向蒸馏水中滴加浓H2SO4时,溶液的温度升高,KW增大,错误;B项常温下,0.005mol·L-1Ba(OH)2溶液的c(OH-)=0.01mol·L-1,pH=12,正确;C项Na2CO3水解的离子方程式应该为:CO32- + H2O HCO3-+OH-,错误;D项在CH3COONH4溶液中CH3COO-、NH4+均水解,且水解的程度相当,溶液显中性,但水的电离程度增大,错误。
HCO3-+OH-,错误;D项在CH3COONH4溶液中CH3COO-、NH4+均水解,且水解的程度相当,溶液显中性,但水的电离程度增大,错误。
考点:考查电解质溶液原理。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

(1)上述反应的平衡常数表达式为K=_______________________。
(2)计算15~20min范围内:甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因: 。
(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是( )
| A.C(Na+)>C(CN—)>C( H+)>C(OH―) | B.C(HCN)+C (CN—)=0.04mol·L—1 |
| C.C(Na+)+C(H+)= C(CN—)+C(OH―) | D.C(CN—)>C(HCN) |
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下图表示的是某物质所发生的( )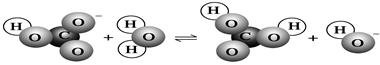
| A.取代反应 | B.水解反应 |
| C.中和反应 | D.电离过程 |
下列有关水的叙述正确的是
| A.水是一种非电解质 |
| B.纯水中c(H+)随着温度的升高而降低 |
| C.由液态水结成冰的过程是一个熵增的过程 |
| D.25℃,pH相同的氢氧化钠溶液与醋酸钠溶液,水的电离度前者小于后者 |
一定温度下,满足下列条件的溶液一定呈酸性的是
| A.pH=6的某溶液 | B.加酚酞后显无色的溶液 |
| C.能与金属Al反应放出H2的溶液 | D.c(H+)>c(OH—)的任意水溶液 |
室温下,对于0.10 mol·L—1的氨水,下列判断正确的是
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |