题目内容
下列说法正确的是( )
A.草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中:c(C2O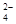 )>c(H2C2O4) )>c(H2C2O4) |
B.在小苏打水溶液中:c(Na+)+c(H+)=c(HCO )+c(CO )+c(CO )+c(OH-) )+c(OH-) |
| C.相同温度下,1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比是2:1 |
D.当氨水与盐酸恰好完全反应时,c(NH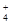 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
A
解析试题分析:A.草酸氢钾溶液呈酸性,说明在0.1mol·L-1KHC2O4溶液中HC2O4-的电离作用大于其水解作用,所以c(C2O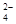 )>c(H2C2O4);正确;B.根据电荷守恒可知:在小苏打水溶液中:c(Na+)+c(H+)=c(HCO
)>c(H2C2O4);正确;B.根据电荷守恒可知:在小苏打水溶液中:c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-),错误;C.相同温度下,同一物质的不同浓度的溶液,浓度越大,电离程度就越小,所以1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比小于2:1,错误;D.当氨水与盐酸恰好完全反应时,产生的是NH4Cl。由于铵根离子水解,所以c(Cl-)>c(NH
)+c(OH-),错误;C.相同温度下,同一物质的不同浓度的溶液,浓度越大,电离程度就越小,所以1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比小于2:1,错误;D.当氨水与盐酸恰好完全反应时,产生的是NH4Cl。由于铵根离子水解,所以c(Cl-)>c(NH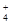 );铵根离子水解消耗水电离产生的OH-,使溶液显酸性,所以c(H+)>c(OH-);盐水解的程度是微弱的,盐电离产生的离子浓度远大于水的电离作用,所以 c(NH
);铵根离子水解消耗水电离产生的OH-,使溶液显酸性,所以c(H+)>c(OH-);盐水解的程度是微弱的,盐电离产生的离子浓度远大于水的电离作用,所以 c(NH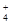 )> c(H+);因此溶液中离子浓度关系是:c(Cl-)>c(NH
)> c(H+);因此溶液中离子浓度关系是:c(Cl-)>c(NH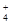 )> c(H+)>c(OH-)。错误。
)> c(H+)>c(OH-)。错误。
考点:考查多元弱酸的酸式盐的水解和电离、离子浓度的大小比较的知识。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

(1)上述反应的平衡常数表达式为K=_______________________。
(2)计算15~20min范围内:甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因: 。
(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
常温下,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH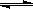 CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水稀释,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
25℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
| A.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是( )
| A.C(Na+)>C(CN—)>C( H+)>C(OH―) | B.C(HCN)+C (CN—)=0.04mol·L—1 |
| C.C(Na+)+C(H+)= C(CN—)+C(OH―) | D.C(CN—)>C(HCN) |
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
室温下,对于0.10 mol·L—1的氨水,下列判断正确的是
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |