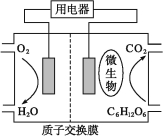
题目内容
【题目】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是
A. 原子序数:D>C>B>A B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-
【答案】B
【解析】短周期元素的离子: A2+、B+、C3-、D-都具有相同的电子层结构,元素在周期表中的位置关系![]() , A、B为金属,C、D为非金属;
, A、B为金属,C、D为非金属;
A、B在周期表中C、D的下一周期,所以原子序数:A>B>D>C,故A错误;
同周期自左而右,半径减小A<B,C>D,电子层数越多半径越大,半径B>A>C>D,故B正确;
aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径C3->D->B+>A2+,故C错误;
D. 非金属性D>C,对应单质的氧化性D>C,所以还原性C3->D-,故D错误。

【题目】碱式碳酸钴[ Cox(OH)y(CO3)2 ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示进行实验。
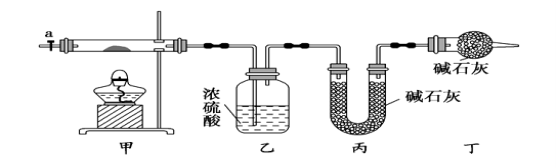
⑴请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中___________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
⑵步骤④中缓缓通入空气数分钟的目的是__________________。
⑶某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_____ _(填字母)连接在_____ ____(填装置连接位置)。
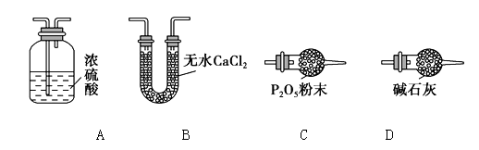
⑷若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为____________________。
⑸CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
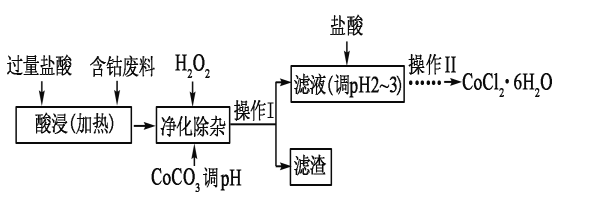
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为__________________。
③加盐酸调整PH为2~3的目的为____________________________。