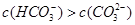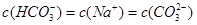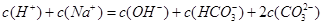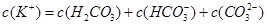题目内容
已知碳酸的电离常数:K1=4.4×10-7,K2=4.7×10-11.HCO3-的水解常数Kh2=2.27×10-8,CO32的水解常数Kh1=2.12×10-4.现将0.2mol/L的KHCO3溶液与0.1mol/L的NaOH溶液等体积混合,下列说法正确的是( )
分析:A、依据碳酸电离平衡常数判断酸性H2CO3>HCO3-,依据离子水解程度和水解平衡常数比较水解显碱性的强弱;
B、将0.2mol/L的KHCO3溶液与0.1mol/L的NaOH溶液等体积混合,得到KHCO3溶液、碳酸钠溶液、碳酸钾溶液;
C、依据溶液中电荷守恒分析判断;
D、依据溶液中物料守恒分析判断;
B、将0.2mol/L的KHCO3溶液与0.1mol/L的NaOH溶液等体积混合,得到KHCO3溶液、碳酸钠溶液、碳酸钾溶液;
C、依据溶液中电荷守恒分析判断;
D、依据溶液中物料守恒分析判断;
解答:解:A、碳酸电离平衡常数,K1>K2,判断酸性H2CO3>HCO3-,依据离子水解程度和水解平衡常数,Kh1>Kh2比较水解显碱性的强弱c(CO32-)>c(HCO3-),故A错误;
B、将0.2mol/L的KHCO3溶液与0.1mol/L的NaOH溶液等体积混合,得到KHCO3溶液、碳酸钠溶液、碳酸钾溶液,离子浓度不同,故B错误;
C、溶液中存在电荷守恒c(H+)+c(K+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D、电解质溶液中存在物料守恒c(K+)=c(H2CO3)+c(HCO3-)+c(CO32-),故D正确;
故选D.
B、将0.2mol/L的KHCO3溶液与0.1mol/L的NaOH溶液等体积混合,得到KHCO3溶液、碳酸钠溶液、碳酸钾溶液,离子浓度不同,故B错误;
C、溶液中存在电荷守恒c(H+)+c(K+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D、电解质溶液中存在物料守恒c(K+)=c(H2CO3)+c(HCO3-)+c(CO32-),故D正确;
故选D.
点评:本题考查了电解质溶液中电离和水解的沉淀分析判断,电荷守恒、物料守恒分析应用,题目难度中等.

练习册系列答案
相关题目
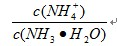 的值
的值 ,碱性
,碱性