题目内容
【题目】下列说法中正确的是
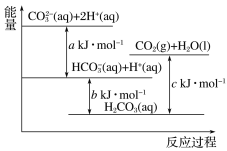
A. 对于吸热反应,生成物总能量一定低于反应物总能量
B. 石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
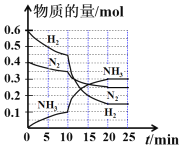
C. 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D. 4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别为243kJ/mol和498kJ/mol,则可推算出H-O键的键能比H-Cl键的键能大
【答案】D
【解析】
A项、反应物总能量低于生成物总能量的反应为吸热反应,故A错误;
B项、石墨和金刚石完全燃烧的化学方程式相同,但石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,则相同条件下,12g的石墨和金刚石充分燃烧放出的热量,金刚石高于石墨,故B错误;
C项、相同条件下的同一可逆反应,热量的数值与化学计量数成正比,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,因可逆反应不可能完全反应,反应生成的氨气的物质的量小于1mol,则该条件下每生成1molNH3放热大于19.3 kJ,故C错误;
D项、反应物的总能量大于生成物的总能量的反应为放热反应,即反应物的键能之和小于生成物的键能之和,则有4E(H—Cl)+498<2×243+4E(H—O),解得E(H—Cl)+3<E(H—O),故D正确。
故选D。

 阅读快车系列答案
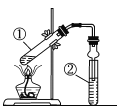
阅读快车系列答案【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 少量的Fe粉中加入足量稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
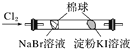
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸先变蓝后变白 | 浓氨水呈碱性且有漂白性 |
D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
A. AB. BC. CD. D