题目内容
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
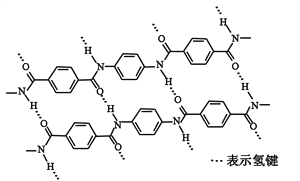
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
【答案】16 sp3 σ键(或非极性键) 2.5NA CO C22- N>O>C 7NA ds N 3d104s1 FeCu3N 非极性 [Cr(H2O)4Cl2]+
【解析】
(1)①原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,硫原子核外有16个电子,所以有16种不同运动状态的电子,故答案为:16。
②H2S2O8中,硫原子价层电子对数=σ键电子对+中心原子上的孤电子对=4+![]() (6-4×1-2)=4,所以采取sp3杂化;由方程式可知生成MnO4-时,S2O82-转化为SO42-,断掉中间的过氧键,即非极性键(或σ键),反应生成1molMnO4-,需要反应2.5NA的S2O82-,即断裂2.5NA的非极性键。故答案为:sp3杂化;σ键(或非极性键);2.5NA。
(6-4×1-2)=4,所以采取sp3杂化;由方程式可知生成MnO4-时,S2O82-转化为SO42-,断掉中间的过氧键,即非极性键(或σ键),反应生成1molMnO4-,需要反应2.5NA的S2O82-,即断裂2.5NA的非极性键。故答案为:sp3杂化;σ键(或非极性键);2.5NA。
(2)①价电子数与原子数都分别相等的粒子是等电子体,因此与CN-互为等电子体的一种分子和一种离子的化学式分别是CO和C22-,故答案为:CO、C22-。
②组成尿素的第二周期元素为N、C、O,同周期从左向右第一电离能增大,氮原子2p轨道半充满,为稳定状态,第一电离能大于O,因此第一电离能大小顺序是N>O>C;由尿素分子的结构式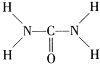 可知:1个C—N键中含有1个σ键,1个C=O键含有1个σ键,σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,故答案为:N>O>C,7NA。
可知:1个C—N键中含有1个σ键,1个C=O键含有1个σ键,σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,故答案为:N>O>C,7NA。
③Cu的价电子排布式为3d104s1,位于第四周期IB族,属于ds区;最高能层符号为N;Cu属于副族元素,价电子包括最外层电子,以及次外层的d能级,即基态铜原子的价电子排布式为3d104s1;能量低的晶胞稳定性强,即Cu替代a位置Fe型晶胞更稳定,每个晶胞均摊:Cu原子的个数为8×1/8=1,Fe位于面心,Fe原子的个数为6×1/2=3,N位于体心,N原子个数1,则Cu替代a位置Fe型化学式为Fe3CuN,故答案为:ds,N,3d104s1,FeCu3N。
(3)①CCl4、CS2都是非极性分子,非极性分子的溶质极易溶于非极性分子形成的溶剂,根据相似相溶原理知,CrO2Cl2是非极性分子,故答案为:非极性。
②1mol固体可生成1mol氯化银沉淀,说明该配合物的分子的外界有1个氯离子,则该配合物阳离子带1个单位的正电荷,其配位数是6,根据氯原子守恒知,则该配合物內界中含有2个氯原子和4个水分子,所以其阳离子为[Cr(H2O)4Cl2]+,故答案为:[Cr(H2O)4Cl2]+。

【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式 | |||
|
|
|
|
铁器在具有![]() 、_____等环境中容易被腐蚀。
、_____等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.![]() 转化为
转化为![]() 。
。
Ⅱ.![]() 在自然环境中形成
在自然环境中形成![]() ,该物质中铁元素的化合价为_______。
,该物质中铁元素的化合价为_______。
Ⅲ.![]() 和
和![]() 反应形成致密的
反应形成致密的![]() 保护层,
保护层,![]() 的作用是_______。
的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.![]() 保护层被氧化为
保护层被氧化为![]() ,如此往复腐蚀,___
,如此往复腐蚀,___![]() +___
+___![]() +___
+___![]()
![]() ____
____![]() (将反应补充完整)
(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成![]() 保护层,法如下: 将铁器浸没在盛有
保护层,法如下: 将铁器浸没在盛有![]() 溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用
溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用![]() 溶液洗涤至无Cl-。
溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____。
②脱氯反应:![]() 。离子反应的本质是离子浓度的减小,比较
。离子反应的本质是离子浓度的减小,比较![]() 与
与![]() 溶解度的大小:__________较大。[填
溶解度的大小:__________较大。[填![]() 与
与![]() ]
]
【题目】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( )
A. 在pH=5的溶液中,Fe3+不能大量存在
B. 混合溶液中c(SO![]() )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
C. 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀
D. 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液