题目内容
【题目】以葡萄糖为原料制得的山梨酸醇(A)和异山梨酸醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:

回答下列问题:
(1)葡萄糖的分子式为______;A中含有的官能团的名称为_______。
(2)C的结构简式为_______;由B到C的反应类型为____。
(3)由D到E的反应方程式为:_________。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),F的可能结构有_____种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为______。
【答案】C6H12O6 羟基  酯化反应
酯化反应  9
9 
【解析】
葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,故A为![]() ,A在浓硫酸作用下发生分子内脱水反应生成B,B与乙酸发生酯化反应生成C,由分子式推知为酯化反应,根据C与D的分子式可知D是C分子中另一个羟基与硝酸发生酯化反应,D在NaOH溶液中发生水解反应,结合E的结构推知B中上方的-OH中-H被-NO2,下方-OH发生酯化反应,故C为
,A在浓硫酸作用下发生分子内脱水反应生成B,B与乙酸发生酯化反应生成C,由分子式推知为酯化反应,根据C与D的分子式可知D是C分子中另一个羟基与硝酸发生酯化反应,D在NaOH溶液中发生水解反应,结合E的结构推知B中上方的-OH中-H被-NO2,下方-OH发生酯化反应,故C为 ,D为
,D为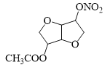 ,据此答题。
,据此答题。
(1)葡萄糖的分子式为C6H12O6;葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,因此A中含有的官能团的名称为羟基,故答案为:C6H12O6,羟基。
(2)根据B的结构简式可知C的结构简式为: ,由B到C的反应为酯化反应,故答案为:
,由B到C的反应为酯化反应,故答案为: ,酯化反应。
,酯化反应。
(3)由D到E的反应是乙酸形成的酯基水解,反应方程式为: ,故答案为:
,故答案为:  。
。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),说明F分子中含有羧基,7.30g的F的物质的量为7.30g÷146g/mol=0.05mol,二氧化碳的物质的量为0.1mol,因此F分子中含有2个羧基,则F相当于是丁烷分子中的两个氢原子被羧基取代,如果是正丁烷,根据定一移一可知有6种结构,如果是异丁烷,则有3种,所以可能有的结构有9种,即![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、 ,其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为
,其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为 ,故答案为:9,
,故答案为:9, 。
。

 阅读快车系列答案
阅读快车系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,正反应方向是放热反应 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A.AB.BC.CD.D








