题目内容
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
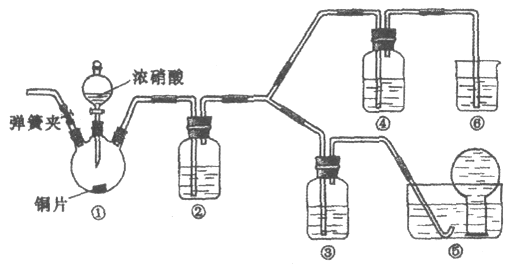
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2 NaOH=NaNO3+NaNO2+H2O
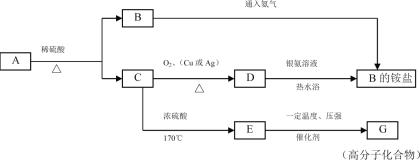
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是_____。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后_______。
(3)装置①中发生反应的化学方程式是______。
(4)装置②的作用是_____,发生反应的化学方程式是______。
(5)该小组得出的结论所依据的实验现象是______。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确,这些方案中可行的是______。(选填字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
【答案】3mol/L稀硝酸、浓硝酸、氢氧化钠溶液 通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 将NO2转化为NO 3NO2+H2O===2HNO3+NO 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色 acd
【解析】
原理检查装置气密性后,打开弹簧夹通入CO2排除装置中空气;关闭弹簧夹,①装置打开分液漏斗活塞,铜与浓硝酸反应制得二氧化氮气体;NO2气体通入②装置中,二氧化氮与水反应生成NO;③装置中是稀硝酸验证不能氧化NO;⑤装置排水法收集NO;④装置中浓硝酸验证可以氧化NO2;⑥装置中NaOH溶液吸收NO2。
(1)根据装置特点和实验目的判断;
(2)根据空气造成的影响确定如何实施操作;同时根据一氧化氮的性质判断装置⑤的操作;
(3)根据铜和浓硝酸的性质结合实验现象判断产物,从而确定反应方程式;
(4)根据二氧化氮的性质且能转化为一氧化氮选择试剂;根据实验现象结合二氧化氮的性质书写反应方程式;
(5)根据对比实验③、④的实验现象判断;
(6)根据是否改变溶液中硝酸铜的质量分数或溶解气体的浓度判断;
(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,装置③中应该盛放稀硝酸;
答案:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出;
答案:通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O;
答案:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,
答案:将NO2转化为NO; 3NO2+H2O=2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体;
答案:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色;
(6)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(a、c方案)再观察颜色变化.二是增加溶液中Cu(NO3)2溶液的浓度(d方案)观察反应后的颜色变化;
答案:a c d

 阅读快车系列答案
阅读快车系列答案【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸(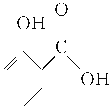 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8 g(0.1 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成共沸物,沸点为85 ℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95 ℃下恒温加热反应1.5小时;
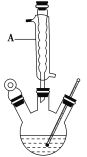
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5% NaHCO3溶液和水洗涤;分离出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221~224 ℃的馏分,得水杨酸甲酯9.12 g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 (g·cm-3) | 熔点 (℃) | 沸点 (℃) |
水杨酸 甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 218~ 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是________,加入沸石的作用是_____________________。若加热后发现未加沸石,应采取的正确方法是________________________________________________。
(2)制备水杨酸甲酯时,最合适的加热方法是____________________________________________。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是___________________________________________。
(4)反应结束后,分离出甲醇采用的方法是__________________________________________。
(5)实验中加入无水硫酸镁的作用是__________________________________________。本实验的产率为________(保留两位有效数字)。