题目内容
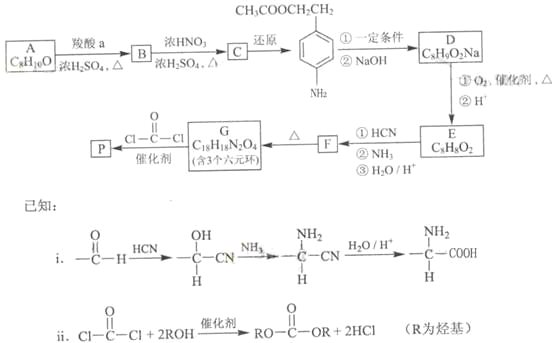
【题目】下表为周期表的一部分,其中的编号代表对应的元素。

(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
【答案】F 26 4s24p3 H2O H2O 离子 低
【解析】
根据元素在周期表中的位置可知,①为H元素,②为Be元素,③为C元素,④为N元素,⑤为O元素,⑥为F元素,⑦为S元素,⑧为K元素,⑨为Fe元素,⑩为As元素,结合元素周期表以及元素的性质进行答题。
(1)非金属性越强,电负性越大。在所给的元素中,氟元素的非金属性最强,则电负性最大的是氟元素,化学式为F,故答案为:F。
(2)由分析可知:⑨为Fe元素,铁元素的原子序数为26,原子核外有几个电子,其原子核外电子就有几种运动状态,所以Fe元素有26种运动状态不同的电子,故答案为:26。
(3)由分析可知:⑩为As元素,As为第四周期第ⅤA族元素,所以原子核外价电子排布式为4s24p3,故答案为:4s24p3。
(4)由分析可知:⑤为O元素、⑦为S元素,同一主族的元素,非金属性逐渐减弱,非金属性越强,形成的氢化物越稳定,非金属性:O>S,所以O和S元素形成的氢化物中较稳定的是H2O;根据组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,但水中含有氢键,使得水的熔沸点变大,所以沸点较高的是H2O,故答案为:H2O,H2O。
(5)分析可知:⑦为S元素、⑧为K元素,由S元素和K元素形成的化合物为K2S,属于离子晶体,K2S和Na2O均属于离子化合物,离子电荷相同,离子半径K+>Na+,S2->O2-,Na2O的晶格能比K2S的大,所以K2S的熔点比Na2O的低,故答案为:低。