题目内容
Fe2+和I-是两种常见的还原性离子.
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为 .
(2)请以FeSO4溶液、KI溶液、氯水、2% KSCN为试剂证明I-的还原性强于Fe2+.设计实验方案,补充完成实验步骤、预期现象和结论.
(3)利用(2)中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, .
(4)向含2mol FeI2溶液中通入2.5mol Cl2时,请写出总的离子方程式: .
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为
(2)请以FeSO4溶液、KI溶液、氯水、2% KSCN为试剂证明I-的还原性强于Fe2+.设计实验方案,补充完成实验步骤、预期现象和结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 现象:溶液变成黄色. 结论: |
| 步骤2: | 现象: 结论: |
(4)向含2mol FeI2溶液中通入2.5mol Cl2时,请写出总的离子方程式:
考点:离子方程式的书写,氧化性、还原性强弱的比较,铁盐和亚铁盐的相互转变
专题:离子反应专题,元素及其化合物
分析:(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,发生氧化还原反应生成铁离子;向KI溶液中滴加氯水,溶液由无色变成黄色,发生氧化还原反应生成KCl和碘;
(2)取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水,发生氧化还原反应可能生成铁离子,可能生成碘,可检验铁离子以确定;
(3)证明碘与铁的化合物中铁显+2价,则溶液中加KSCN不变色;
(4)含2mol FeI2溶液中通入2.5mol Cl2时,先氧化碘离子,再由电子守恒可知,碘离子全部被氧化,亚铁离子部分被氧化.
(2)取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水,发生氧化还原反应可能生成铁离子,可能生成碘,可检验铁离子以确定;
(3)证明碘与铁的化合物中铁显+2价,则溶液中加KSCN不变色;
(4)含2mol FeI2溶液中通入2.5mol Cl2时,先氧化碘离子,再由电子守恒可知,碘离子全部被氧化,亚铁离子部分被氧化.
解答:
解:(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,发生氧化还原反应生成铁离子,离子反应为2Fe2++Cl2═2Fe3++2Cl-;向KI溶液中滴加氯水,溶液由无色变成黄色,发生氧化还原反应生成KCl和碘,离子反应为2I-+Cl2═I2+2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;2I-+Cl2═I2+2Cl-;
(2)取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水,溶液变为黄色,发生氧化还原反应可能生成铁离子,可能生成碘,为验证结论可向试管中继续滴加几滴2%KSCN溶液,观察到溶液不变血红色,则证明I-的还原性强于Fe2+,
故答案为:
(3)证明碘与铁的化合物中铁显+2价,则取少量样品溶于水,滴加几滴2%KSCN溶液,无明显现象,再加入过量的氯水,溶液变血红色,可说明含亚铁离子,
故答案为:滴加几滴2%KSCN溶液,无明显现象,再加入过量的氯水,溶液变血红色;
(4)含2mol FeI2溶液中通入2.5mol Cl2时,先氧化碘离子,再由电子守恒可知,碘离子全部被氧化,亚铁离子部分被氧化,离子反应为2Fe2++8I-+5Cl2═4I2+10Cl-+2Fe3+,故答案为:2Fe2++8I-+5Cl2═4I2+10Cl-+2Fe3+.
故答案为:2Fe2++Cl2═2Fe3++2Cl-;2I-+Cl2═I2+2Cl-;
(2)取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水,溶液变为黄色,发生氧化还原反应可能生成铁离子,可能生成碘,为验证结论可向试管中继续滴加几滴2%KSCN溶液,观察到溶液不变血红色,则证明I-的还原性强于Fe2+,
故答案为:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 现象:溶液变成黄色. 结论:可能是生成了Fe3+、也可能是生成了I2 |
| 步骤2:向试管中继续滴加几滴2%KSCN溶液 | 现象:溶液不变血红色; 结论:证明I-的还原性强于Fe2+ |
故答案为:滴加几滴2%KSCN溶液,无明显现象,再加入过量的氯水,溶液变血红色;
(4)含2mol FeI2溶液中通入2.5mol Cl2时,先氧化碘离子,再由电子守恒可知,碘离子全部被氧化,亚铁离子部分被氧化,离子反应为2Fe2++8I-+5Cl2═4I2+10Cl-+2Fe3+,故答案为:2Fe2++8I-+5Cl2═4I2+10Cl-+2Fe3+.
点评:本题考查性质实验方案的设计及离子反应,为高频考点,把握现象与发生的氧化还原反应为解答的关键,侧重分析能力与实验能力的考查,综合性较强,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11.现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL 1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是( )
| A、c(HCO3-)<c(CO32-) |
| B、c(HCO3-)>c(HSO3-) |
| C、c(CO32-)+c(HCO3-)═c(SO32-)+c(HSO3-) |
| D、两溶液都能使酸性高锰酸钾溶液褪色 |

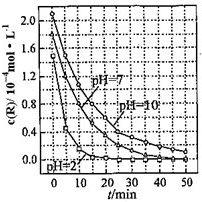 一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.请回答下列问题:
一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.请回答下列问题: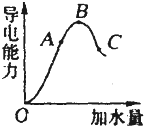 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答: