题目内容
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11.现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL 1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是( )
| A、c(HCO3-)<c(CO32-) |
| B、c(HCO3-)>c(HSO3-) |
| C、c(CO32-)+c(HCO3-)═c(SO32-)+c(HSO3-) |
| D、两溶液都能使酸性高锰酸钾溶液褪色 |
考点:离子浓度大小的比较,二氧化硫的化学性质
专题:电离平衡与溶液的pH专题
分析:标准状况下,2.24L二氧化碳和二氧化硫的物质的量为0.1mol,氢氧化钠的物质的量为0.15mol,根据反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O、2SO2+3NaOH=Na2SO3+NaHSO3+H2O可知,反应生成了等物质的量浓度的溶质碳酸钠、碳酸氢钠、亚硫酸钠、亚硫酸氢钠,
A.Ka1(H2CO3)>Ka2(H2CO3),则相同条件下Na2CO3的水解程度大于NaHCO3,据此判断溶液中碳酸根离子与碳酸氢根离子浓度关系;
B.两溶液中溶质亚硫酸钠、亚硫酸氢钠的浓度相等,根据Ka2(H2SO3)>Ka2(H2CO3)可知等温等浓度下HSO3-的电离程度大于HCO3-,据此判断c(HCO3-)、c(HSO3-)的浓度大小;
C.溶液中一定满足物料守恒,根据两溶液中物料守恒进行判断;
D.碳酸钠、碳酸氢钠都不与高锰酸钾溶液反应,所以碳酸钠、碳酸氢钠的溶液不能使酸性高锰酸钾溶液褪色.
A.Ka1(H2CO3)>Ka2(H2CO3),则相同条件下Na2CO3的水解程度大于NaHCO3,据此判断溶液中碳酸根离子与碳酸氢根离子浓度关系;
B.两溶液中溶质亚硫酸钠、亚硫酸氢钠的浓度相等,根据Ka2(H2SO3)>Ka2(H2CO3)可知等温等浓度下HSO3-的电离程度大于HCO3-,据此判断c(HCO3-)、c(HSO3-)的浓度大小;
C.溶液中一定满足物料守恒,根据两溶液中物料守恒进行判断;
D.碳酸钠、碳酸氢钠都不与高锰酸钾溶液反应,所以碳酸钠、碳酸氢钠的溶液不能使酸性高锰酸钾溶液褪色.
解答:
解:标准状况下,n=
=
=0.1mol,n(CO2)=n(SO2)=0.1mol,氢氧化钠的物质的量为:n(NaOH)=c?V=1mol/L×0.15L=0.15mol,则发生的反应方程式分别为:2CO2+3NaOH=Na2CO3+NaHCO3+H2O、2SO2+3NaOH=Na2SO3+NaHSO3+H2O,
A.由Ka1(H2CO3)>Ka2(H2CO3)可知,等温等浓度下Na2CO3的水解程度大于NaHCO3,则溶液中存在的离子浓度:c(HCO3-)>c(CO32-),故A错误;
B.由Ka2(H2SO3)>Ka2(H2CO3)可知,等温等浓度下HSO3-的电离程度大于HCO3-,则溶液中含有的离子浓度:c(HCO3-)>c(HSO3-),故B正确;
C.由物料守恒可知,c(CO32-)+c(HCO3-)+c(H2CO3)=c(SO32-)+c(HSO3-)+c(H2SO3),由Ka1(H2SO3)>Ka1(H2CO3)可知,等温等浓度下HSO3-的水解程度小于HCO3-,则溶液中c(H2CO3)>c(H2SO3),故c(CO32-)+c(HCO3-)<<c(SO32-)+c(HSO3-),故C错误;
D.Na2SO3和NaHSO3均有还原性,能使酸性高锰酸钾溶液褪色,而Na2CO3和NaHCO3则不能,故D错误;
故选B.
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
A.由Ka1(H2CO3)>Ka2(H2CO3)可知,等温等浓度下Na2CO3的水解程度大于NaHCO3,则溶液中存在的离子浓度:c(HCO3-)>c(CO32-),故A错误;
B.由Ka2(H2SO3)>Ka2(H2CO3)可知,等温等浓度下HSO3-的电离程度大于HCO3-,则溶液中含有的离子浓度:c(HCO3-)>c(HSO3-),故B正确;
C.由物料守恒可知,c(CO32-)+c(HCO3-)+c(H2CO3)=c(SO32-)+c(HSO3-)+c(H2SO3),由Ka1(H2SO3)>Ka1(H2CO3)可知,等温等浓度下HSO3-的水解程度小于HCO3-,则溶液中c(H2CO3)>c(H2SO3),故c(CO32-)+c(HCO3-)<<c(SO32-)+c(HSO3-),故C错误;
D.Na2SO3和NaHSO3均有还原性,能使酸性高锰酸钾溶液褪色,而Na2CO3和NaHCO3则不能,故D错误;
故选B.
点评:本题考查盐溶液中离子浓度大小关系、电离常数的应用、物料守恒原理、盐类水解原理等相关知识,题目难度中等,注意掌握盐的水解原理,能够根据电荷守恒、物料守恒、盐的水解等知识判断溶液中各离子浓度大小,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
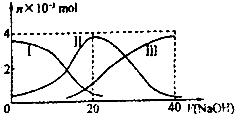 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D、向NaHA溶液加人水的过程中,pH可能增大也可能减小 |
草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol?L-1 NaHC2O4溶液中滴加0.01mol?L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A、V(NaOH)=0时,c(H+)=1×10-2mol?L-1 |
| B、V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C、V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D、V(NaOH)>10mL时,一定有c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-) |
为减少汽车尾气对大气造成的污染,目前市场上推出了使用乙醇汽油(在汽油中加入适量乙醇)的汽车.下列叙述错误的是( )
| A、乙醇汽油是一种化合物 |
| B、汽车使用乙醇汽油可以减少有害气体的排放 |
| C、乙醇充分燃烧生成CO2和H2O |
| D、用粮食发酵可制得乙醇 |
新航空燃油税从2012年2月14日开始征收,燃油税“燃”来好处之一节能减排,抑制燃油不合理消费.下列说法错误的是( )
| A、石油的裂解是生产乙烯的主要方法 |
| B、裂化汽油可以用于萃取溴水中的溴 |
| C、使用乙醇汽油,可以改善城市的空气质量 |
| D、石油在加热和催化剂作用下,可得到苯、甲苯等芳香烃 |
X、Y分别是两种药物,其结构如图.
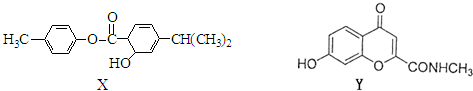
下列说法不正确的是( )
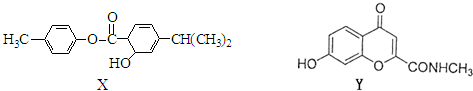
下列说法不正确的是( )
| A、1mol X与NaOH溶液反应,最多消耗2 mol NaOH |
| B、X、Y都有较强的水溶性 |
| C、X、Y都能使KMnO4溶液褪色 |
| D、X、Y的水解产物有可能发生聚合反应 |
下列实验中,不能观察到明显现象的是( )
| A、把一段打磨过的铝条放入少量冷水中 |
| B、把氯气通入到FeSO4溶液中 |
| C、把绿豆大的钾投入乙醇中 |
| D、把溴水滴加到KI淀粉溶液中 |
NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A、5.6g铁在足量氯气中燃烧,电子转移0.3NA个 |
| B、标准状况下,2.24L水中含有0.1NA个水分子 |
| C、1.12L氯气中反应0.1NA个氯原子 |
| D、12g石墨和C60的混合固体中,含碳原子NA个 |