题目内容
【题目】如图是部分短周期元素化合价与原子序数的关系图
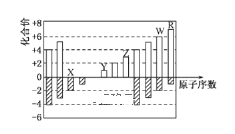
请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为 ____________
(4)某阴离子 Wa2-(a 为2 6之间的数字)在碱性溶液中被 BrO3离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH离子的物质的量之比为 2:3,则 a =____________。
【答案】Na>Al>O  2ClO2+2CN-=N2+2CO2+2Cl- 3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O
2ClO2+2CN-=N2+2CO2+2Cl- 3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O
【解析】
都是短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,原子序数大于Na为Al元素,W的化合价为+6、-2价,故W为S元素,R的最高正价为+7价,应为Cl元素,结合元素周期律与元素化合物的性质解答该题;
(4) W为S元素,则S元素的化合价由-![]() 升高为+6价,Br元素的化合价由+5价降低为-1价,BrO3-和OH-的物质的量之比为2:3,2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,由电荷守恒可知,4x+4+6=4xa+4,由氧原子守恒可知18=8xa+3,解得x=
升高为+6价,Br元素的化合价由+5价降低为-1价,BrO3-和OH-的物质的量之比为2:3,2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,由电荷守恒可知,4x+4+6=4xa+4,由氧原子守恒可知18=8xa+3,解得x=![]() ,a=5,以此解答。
,a=5,以此解答。
由分析知:X为O元素、Y为Na元素、Z为Al元素、W为S元素、R为Cl元素;
(1)同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O;
(2)O 与 Na 形成化合物Na2O2,是离子型化合物,其电子式为 ;
;
(3)ClO2是一种强氧化性气体,能将 CN-氧化,生成N2和CO2,则该反应离子方程式为2ClO2+2CN-=N2+2CO2+2Cl-;
(4) BrO3-和OH-的物质的量之比为2:3,2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,由电荷守恒可知,4x+4+6=4xa+4,由氧原子守恒可知18=8xa+3,解得x=![]() ,a=5;2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,a=5时,离子反应为3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O。
,a=5;2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,a=5时,离子反应为3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案