题目内容
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
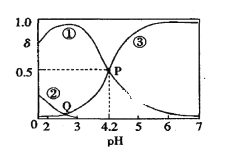
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
【答案】B
【解析】
A.H2C2O4是二元弱酸,①表示HC2O4-的分布曲线,②表示H2C2O4的分布曲线、③表示C2O42-的分布曲线,故A错误;
B.p点c(HC2O4-)=c(C2O42-),pH=4.2,20℃时,H2C2O4的二级电离平衡常数Ka2=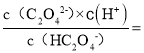 1×10-4.2,故B正确;
1×10-4.2,故B正确;
C. Q点的溶液呈酸性,c(OH-)<c(H+),对应溶液中lgc(H+)>lgc(OH-),故C错误;
D. 0.100 molL-1的NaHC2O4溶液中存在物料守恒,c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-),电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(OH-)+c(HC2O4-),计算得到c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4),故D错误。

练习册系列答案
相关题目