题目内容
11.向H2O2溶液中加入适量稀硫酸酸化的硫酸亚铁溶液,依次观察到如下现象:①反应刚开始,仅有少量气泡产生;
②反应片刻后,有大量气泡产生;
③试管底部最终出现红褐色沉淀.下列判断正确的是( )
| A. | ①中仅发生一个反应 | |
| B. | Fe3+能催化H2O2的分解 | |
| C. | 反应过程中溶液pH不断减小 | |
| D. | FeSO4与等物质的量的H2O2恰好反应 |
分析 过氧化氢具有强氧化性,将亚铁离子氧化为铁离子,反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
过氧化氢在铁离子作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,
起始反应即①中使c(H+)降低,使Fe3++3H2O Fe(OH)3+3H+平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀,据此分析.
Fe(OH)3+3H+平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀,据此分析.
解答 解:过氧化氢具有强氧化性,将亚铁离子氧化为铁离子,反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
过氧化氢在铁离子作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,
起始反应即①中使c(H+)降低,使Fe3++3H2O Fe(OH)3+3H+平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀;
Fe(OH)3+3H+平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀;
A.①中发生双氧水分解和双氧水与亚铁离子的氧化还原反应,存在两个反应,故A错误;
B.②反应片刻后,有大量气泡产生,说明发育生成的铁离子起到催化剂的作用,故B正确;
C.根据方程式2Fe2++H2O2+2H+=2Fe3++2H2O可知反应消耗氢离子,pH不断增大,故C错误;
D.由2Fe2++H2O2+2H+=2Fe3++2H2O可知,FeSO4与H2O2按照物质的量比2:1参加反应,故D错误.
故选B.
点评 本题考查了氧化还原反应、双氧水的性质等,题目难度不大,根据溶液中发生的反应分析.

练习册系列答案
相关题目
1.下列有关氯化钠的实验中,选用的实验用品都能用到的是( )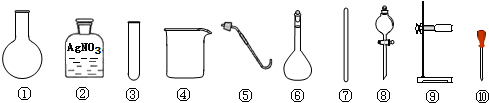

| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
19.亮菌甲素适用于治疗急性胆囊炎,其结构简式如图所示.下列有关叙述正确的是( )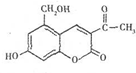

| A. | 亮菌甲素分子式为C12H11O5,属于稠环芳香烃 | |
| B. | 亮菌甲素具有弱酸性,说明羟基对苯环有影响 | |
| C. | 1mol亮菌甲素最多能与2molNaOH发生反应 | |
| D. | 1mol亮菌甲素最多能与5molH2发生加成反应 |
6.现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
Ⅰ.乙元素的主要化合价:最高正价+最低负价=2
Ⅱ.原子的核外电子层数:丁>乙=丙=2甲
III.原子的最外层电子数:甲+丙=乙+丁=8
则下列说法不正确的是( )
Ⅰ.乙元素的主要化合价:最高正价+最低负价=2
Ⅱ.原子的核外电子层数:丁>乙=丙=2甲
III.原子的最外层电子数:甲+丙=乙+丁=8
则下列说法不正确的是( )
| A. | 乙原子的最外层有5个电子,其氢化物含有极性键 | |
| B. | 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强 | |
| C. | 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物完全反应形成的盐的溶液显酸性 | |
| D. | 乙、丙两元素形成的氢化物稳定性丙的强于乙 |
19.下列过程没有发生化学反应的是( )
| A. | 往鲜榨苹果汁中加入适量柠檬汁防止苹果汁变色 | |
| B. | 做馒头时加一些面碱(Na2CO3)避免馒头发酸 | |
| C. | 采用添加有“光触媒”的硅藻泥做装饰材料,净化室内空气,避免装修污染 | |
| D. | 用汽油洗掉衣物沾上的油渍 |
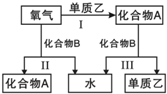 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题: ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示). W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题: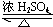 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.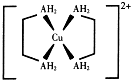 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.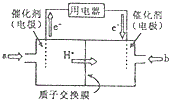 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空: