题目内容
11. (1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.
(1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.(2)二甲醚(CH3OCH3)中氧原子的杂化方式为sp3,二甲醚的沸点比乙醇(CH3CH2OH)的沸点低.
(3)已知NH3容易与H+结合生成NH4+,但NF3却难于H+结合,其原因是F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与H+形成配离子.
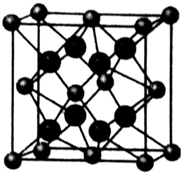
(4)O2-离子和Na+离子形成的晶胞如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何图形为立方体.
分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式,提供空轨道的原子和提供孤电子对的原子之间易形成配位键;CN-中含有三键,三键中含有两个π键;
(2)二甲醚(CH3OCH3)中氧原子形成2个共价键,还有两个孤电子对;CH3CH2OH含氢键,使其沸点升高;
(3)根据电负性的角度分析;
(4)O和Na形成的一种只含有离子键的离子化合物为Na2O,该晶胞结构中小球有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,大球在内部,共有8个,所以小球为O2-,大球为Na+.
解答 解:(1)亚铁离子含有空轨道,N原子含有孤电子对,所以能形成配位键;铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,CN-中含有三键,三键中含有两个π键,则1molCN-中含有π键的数目为2NA;
故答案为:配位键;1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)二甲醚(CH3OCH3)中氧原子形成2个共价键,还有两个孤电子对,所以氧原子的价层电子对数为4,其杂化方式为sp3;CH3CH2OH含氢键,使其沸点升高,CH3CH2OH的沸点高于CH3OCH3的沸点,
故答案为:sp3;低;
(3)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与H+形成配离子;
故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与H+形成配离子;
(4)O和Na形成的一种只含有离子键的离子化合物为Na2O,该晶胞结构中小球有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,大球在内部,共有8个,所以小球为O2-,大球为Na+,以晶胞中上面心O2-离子为研究对象,距一个O2-周围最近的Na+离子有8个,位于晶胞中上层4个Na+及上面晶胞中的下层4个Na+,8个Na+离子形成立方体结构,
故答案为:立方体.
点评 本题考查知识点较多,为原子结构与性质的习题,涉及配位键、电子排布、共价键的类型、氢键对物质性质的影响、晶体结构及其计算,(4)为解答的难点,题目难度中等.

| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
| A. | 往鲜榨苹果汁中加入适量柠檬汁防止苹果汁变色 | |
| B. | 做馒头时加一些面碱(Na2CO3)避免馒头发酸 | |
| C. | 采用添加有“光触媒”的硅藻泥做装饰材料,净化室内空气,避免装修污染 | |
| D. | 用汽油洗掉衣物沾上的油渍 |
| A. | CH4 | B. | C2H4O2 | C. | 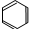 | D. | C8H18 |
| A. | 同分异构体因结构不同,化学性质一定差别很大 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 同分异构体不可能互为同系物 |
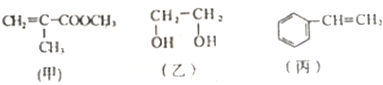
| A. | 甲物质可以在引发剂作用下生成有机高分子化合物 | |
| B. | 甲、乙、丙三种物质都可以发生加成反应 | |
| C. | 丙物质能够使酸性高锰酸钾溶液褪色 | |
| D. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 |
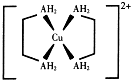 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.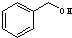 与
与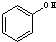 ⑥
⑥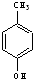 与
与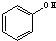
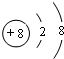 ,D元素在周期表中的位置是第三周期ⅥA族.
,D元素在周期表中的位置是第三周期ⅥA族.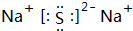 ,氢化物的稳定性是A>D(填“>”或“<”).
,氢化物的稳定性是A>D(填“>”或“<”).