题目内容
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )| A. | 用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 | |
| B. | l mol C22H46中含有的C-C键个数约为21×6.02×1023 | |
| C. | 0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023 | |
| D. | 1 mol Na2O2中所含的阴离子数约为2×6.02×1023 |
分析 A.钙为活泼金属,无法在溶液中通过电解获得钙单质;
B.C22H46分子中含有21个碳碳键;
C.24Mg32S中含有28个中子,0.1mol该晶体中含有2.8mol中子;
D.过氧化钠中含有的阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子.
解答 解:A.电解硝酸钙溶液,相当于电解水,阴极电极反应式为:2H++2e-=H2↑,无金属析出,不会得到钙,故A错误;
B.l mol C22H46中含有21mol碳碳键,含有的C-C键个数约为21×6.02×1023,故B正确;
C.0.1mol 24Mg32S晶体中含有2.8mol中子,所含中子总数为2.8×6.02×1023,故C错误;
D.Na2O2中阳离子与阴离子个数比为2:1,1 mol Na2O2中所含的阴离子数约为6.02×1023,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,熟练掌握阿伏伽德罗常数与物质的量、摩尔质量之间的关系为解答关键,注意明确过氧化钠中的阴离子为过氧根离子,为易错点.

练习册系列答案
相关题目
1.下列有关化学用语使用正确的是( )
| A. | 钙离子的结构示意图: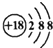 | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | CH4分子的球棍模型: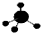 | D. | 丙烯的电子式: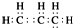 |
18.下列离子方程式中正确的是( )
| A. | 用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | NH4HCO3溶液和过量的NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═FeS↓+2H+ | |
| D. | FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2═I2+2Cl- |
5.下列关于氯气的叙述中不正确的是( )
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| D. | 与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |
15.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 用惰性电极电解饱和食盐水:C1-+2H2O═H2↑+Cl2↑+OH- | |
| B. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
16.下列反应中原子利用率高,符合“绿色化学”要求,无污染环境因素的是( )
| A. | 乙烷与Cl2反应制氯乙烷 | |
| B. | 乙醇和浓硫酸共热制乙烯 | |
| C. | 乙酸和乙醇共热酯化 | |
| D. | 乙烯在催化剂作用下直接氧化制得唯一产物乙醛 |
 、
、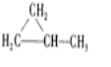 .
.