题目内容
1.下列有关化学用语使用正确的是( )| A. | 钙离子的结构示意图: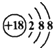 | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | CH4分子的球棍模型: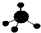 | D. | 丙烯的电子式: |
分析 A.钙离子的核电荷数为20,不是18;
B.乙烯中存在碳碳双键,乙烯的结构简式中碳碳双键不能省略;
C.甲烷为正四面体结构,分子中存在4个碳氢键;
D.丙烯中存在6个碳氢键,电子式中漏掉了一个碳氢键.
解答 解:A.钙离子的核电荷数为20,核外电子总数为18,正确的离子结构示意图为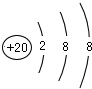 ,故A错误;
,故A错误;
B.乙烯分子中存在官能团碳碳双键,乙烯的结构简式为CH2=CH2,故B正确;
C.甲烷分子中存在4个碳氢键,为正四面体结构,甲烷的球棍模型为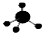 ,故C正确;
,故C正确;
D.丙烯中存在6个碳氢共用电子对,该电子式中少一个碳氢共用电子对,正确的电子式为 ,故D错误,故选BC.
,故D错误,故选BC.
点评 本题考查了电子式、结构简式、离子结构示意图、球棍模型等化学用语的判断,题目难度中等,注意掌握常见的化学用语的概念及表示方法,明确离子结构示意图与原子结构示意图的表示方法及区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列有关常见有机物说法正确的是( )
| A. | 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 | |
| B. | 除去乙醇中少量的乙酸:加入足量生石灰,蒸馏 | |
| C. | 乙醇和苯都不能使溴的四氯化碳溶液和酸性KMnO4溶液褪色 | |
| D. | 石油裂化的主要产品是甲烷、乙烯和苯 |
5.“十二五规划建议”第六条“加快建设资源节约型、环境友好型社会,提高生态文明水平”.下列不符合该“建议”的是( )
| A. | 开发和利用太阳能、氢能等新能源 | B. | 关闭高能耗的小型企业 | ||
| C. | 积极推广煤炭能源 | D. | 开发和推广煤气化和液化技术 |
2.下列除杂方法正确的是( )
| A. | SiO2中含Al2O3杂质,可以加入足量NaOH溶液然后过滤除去 | |
| B. | CO2中含有CO杂质,可以通入盛有CuO的玻璃管且加热 | |
| C. | CO2中含有HCl杂质,可以通过盛有Na2CO3溶液的洗气瓶 | |
| D. | Na2CO3溶液中含有Na2SiO3杂质,可以通入足量的CO2,然后过滤 |
9.下列说法中,正确的是(NA表示阿伏加德罗常数)( )
| A. | 标准状况下,22.4L的水所含有的分子数是NA | |
| B. | 常温常压下,11.2L CO2的中所含O原子数为NA | |
| C. | 32g氧气在标准状况下所占的体积与相同条件下NA个N2分子所占的体积相同 | |
| D. | 标准状况下,11.2L NO、NO2混合气体含有的氮原子数为NA |
6.下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
| A. | AlCl3与氨水 | B. | 铁与稀硝酸 | C. | HCl与Na2CO3 | D. | NaHCO3与Ca(OH)2 |
13.下列离子方程式中,不正确的是( )
| A. | 在稀NaOH溶液中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | 稀硫酸中加入NaOH溶液:H++OH-═H2O | |
| C. | Na2CO3溶液中加入少量的盐酸:CO32-+H+═HCO3- | |
| D. | 碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A. | 用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 | |
| B. | l mol C22H46中含有的C-C键个数约为21×6.02×1023 | |
| C. | 0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023 | |
| D. | 1 mol Na2O2中所含的阴离子数约为2×6.02×1023 |
8.有五瓶溶液分别是:
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
①10mL 0.60moL•L-1NaOH溶液
②20mL 10.50moL•L-1H2SO4溶液
③30mL0.40moL•L-1HCl溶液
④40mL0.30moL•L-1CH3COOH溶液
⑤50mL0.20moL•L-1蔗糖水溶液.
以上各瓶溶液所含离子、分子总数的大小顺序是( )
| A. | ⑤>④>③>②>① | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ①>②>③>④>⑤ |