题目内容
9.甲醇是一种重要的可再生能源,可以通过下列反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).(1)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率υ(H2)=0.15mol/(L•min).
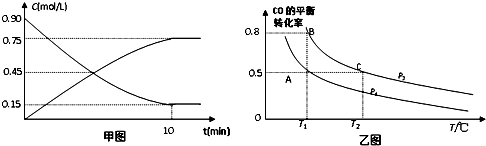
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法能判断该反应达到化学平衡状态的是BCD.
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中混合气体的密度不再改变
D.体系中气体的平均摩尔质量不再改变
②比较A、B、C三点化学反应速率由大到小顺序是υ(C)>υ(B)>υ(A).
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=4L.
(3)已知2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol.
分析 (1)根据反应速率v=$\frac{△c}{△t}$,结合物质表示的反应速率之比等于物质前边的系数之比来计算;
(2)①平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
②根据C的温度高于B,则反应速率C高于B;根据该反应压强越大,CO平衡转化率越大,所以B的压强大于A,则反应速率B高于A;
③A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
(3)利用盖斯定律,1式加2式的二倍即可得到该方程式及焓变;
解答 解:(1)用甲醇表示的反应速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氢气表示的反应速率是甲醇的2倍,即0.15mol/(L•min),故答案为:0.15mol/(L•min);
(2)①A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.因为质量一直不变,但体积在变,所以体系中混合气体的密度不再改变,达到了平衡,故C正确;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BCD.
②根据C的温度高于B,则反应速率C高于B;根据该反应压强越大,CO平衡转化率越大,所以B的压强大于A,则反应速率B高于A,所以A、B、C三点化学反应速率由大到小顺序是υ(C)>υ(B)>υ(A),故答案为:υ(C)>υ(B)>υ(A);
③A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V}){\;}^{2}}$=4,V=4L,
故答案为:4L;
(3)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
点评 本题主要考查了热化学方程式的书写、化学平衡状态的判断、平衡的计算等,属于综合知识的考查,难度大.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | Al (Fe):浓硝酸 | B. | MgO(Al2O3):盐酸 | ||
| C. | FeCl3(FeCl2):氯水 | D. | FeCl2(CuCl2):氢氧化氢钠溶液 |
| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
 如图,甲、乙为相互串联的两个电解池,请回答下列问题:
如图,甲、乙为相互串联的两个电解池,请回答下列问题: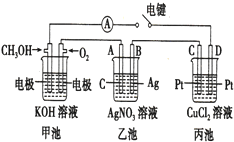 某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转. 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1